テトラヒドロフラン (THF) は無色の有機化合物です。幅広い物質を溶解する能力があるため、さまざまな産業で溶剤として一般的に使用されています。
| IUPAC名 | オキソラン |
| 分子式 | C4H8O |
| CAS番号 | 109-99-9 |
| 同義語 | THF、オキサシクロペンタン、ブチレンオキシド、ジエチレンオキシド、シクロテトラメチレンオキシド |
| インチチ | InChI=1S/C4H8O/c1-2-4-5-3-1/h1-4H2 |
テトラヒドロフランの性質
テトラヒドロフランの配合
テトラヒドロフラン (THF) の化学式は C4H8O です。これは、4 つの炭素原子と 1 つの酸素原子を含む 5 員環を持つ環状エーテルです。 THF は沸点が低く、さまざまな産業で溶媒として一般的に使用されています。
テトラヒドロフランのモル質量
THF のモル質量は約 72.11 g/mol です。この値は、分子式の構成原子の原子量を加算することによって計算されます。 THF は比較的分子量が低いため、沸点が低く揮発性が低く、広範囲の有機化合物に対して効果的な溶媒となっています。
テトラヒドロフランの沸点
THF の沸点は標準大気圧で 66°C (151°F) です。 THF は沸点が低いため、グリニャール反応などの高温を必要とする化学反応の溶媒として役立ちます。ただし、沸点が低いということは、THF が非常に揮発性であることも意味するため、取り扱いには注意が必要です。
テトラヒドロフラン 融点
THF の融点は約 -108.5°C (-163.3°F) です。 THF は室温では液体ですが、低温では固化することがあります。 THF は融点が低いため、低温用途の極低温溶媒として役立ちます。
テトラヒドロフランの密度 g/mL
THF の密度は、20°C (68°F) で約 0.889 g/mL です。この値は、他の一般的な溶媒と比較して比較的低いです。 THF は低密度であるため、反応混合物の全体的な密度を下げることができるため、密度に敏感な反応の溶媒として役立ちます。
テトラヒドロフランの分子量
THF の分子量は約 72.11 g/mol です。この値は、分子式の構成原子の原子量を加算することによって計算されます。 THF は分子量が比較的低いため、沸点と揮発性が低くなります。
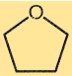
テトラヒドロフランの構造
THF は 4 つの炭素原子と 1 つの酸素原子を含む 5 員環構造を持っています。炭素原子は四面体状に配置されており、各炭素原子は他の 2 つの炭素原子と 1 つの水素原子に結合しています。酸素原子は炭素原子と水素原子に結合しています。
テトラヒドロフランの溶解度
THF は、広範囲の有機化合物を溶解できる極性非プロトン性溶媒です。 THF は水と混和性があり、さまざまな化学反応の共溶媒として一般的に使用されます。ただし、THFは材質によっては適合しない場合がありますので、使用前に適合性を確認することが重要です。
| 外観 | 無色の液体 |
| 比重 | 0.889 |
| 色 | 無色 |
| 匂い | エーテルの匂い |
| モル質量 | 72.11 g/モル |
| 密度 | 0.889g/ml |
| 融合点 | −108.5℃(−163.3°F) |
| 沸点 | 66°C (151°F) |
| フラッシュドット | −14℃(7°F) |
| 水への溶解度 | 混和性 |
| 溶解性 | エタノール、エーテル、アセトン、ベンゼンに可溶 |
| 蒸気圧 | 20℃で200mmHg |
| 蒸気密度 | 2.5 (空気 = 1) |
| pKa | 25.3 |
| pH | ニュートラル (7) |
テトラヒドロフランの安全性と危険性
テトラヒドロフラン (THF) は、安全性と健康上のいくつかのリスクを引き起こします。 THF は引火性が高く、室温で発火する可能性があります。また、加熱または燃焼すると有毒なフュームが発生する可能性があります。 THF への曝露は皮膚や目の炎症を引き起こす可能性があり、長期曝露は肝臓や腎臓への損傷を引き起こす可能性があります。 THF はめまいや頭痛を引き起こすことも知られており、繰り返し吸入すると呼吸障害を引き起こす可能性があります。 THF の取り扱いには注意し、手袋や安全メガネなどの保護具を着用する必要があります。 THF は、熱源や不適合物質から離れた、涼しく換気の良い場所に保管する必要があります。
| ハザードシンボル | 可燃性、有毒 |
| セキュリティの説明 | 引火性の高い液体および蒸気。重度の眼刺激を引き起こします。眠気やめまいを引き起こす可能性があります。飲み込んだり吸入すると有害な可能性があります。 |
| 国連識別番号 | UN2056 |
| HSコード | 29321100 |
| 危険等級 | 3 (引火性液体) |
| 梱包グループ | Ⅱ |
| 毒性 | LD50 (経口、ラット) – 5,410 mg/kg |
テトラヒドロフランの合成方法
テトラヒドロフラン (THF) を合成するには、いくつかの方法を使用できます。
一般的な方法には、フランの接触水素化が含まれます。これには、水素ガスの存在下でフラン蒸気をニッケルまたはパラジウム触媒上に通過させることが含まれます。結果として生じる反応により、THF と水が副生成物として生成されます。
別の方法では、 1,4-ブタンジオールと硫酸を反応させ、その後蒸留して THF を生成します。濃硫酸の危険性のため、この方法はあまり一般的ではありません。
1,4-ブタンジオールの酸触媒による脱水は、THFを合成する別の方法です。この方法では、1,4-ブタンジオールを硫酸などの強酸で加熱して水を除去し、THFを生成します。
さらに、THFは、セルロースまたは他のバイオマス由来の糖の接触水素化分解によって得ることができます。この方法は、再生可能な THF 生産源の可能性があるため、関心が高まっています。
各方法には長所と短所があり、選択される具体的な方法は、コスト、原材料の入手可能性、最終製品の望ましい純度などの要因によって異なります。
テトラヒドロフランの用途
テトラヒドロフラン (THF) は、次のようなさまざまな産業および実験室用途に使用できます。
- 溶剤:溶解力が高く沸点が低いため、さまざまな有機化合物の溶剤として一般的に使用されます。
- 重合: ポリスチレンとポリ塩化ビニルの重合、およびポリウレタンフォームの製造における共溶媒として使用されます。
- 化学合成: グリニャール試薬の調製など、有機化学合成の反応溶媒として使用されます。
- 抽出:アルカロイドやステロイドなどのさまざまな天然物の抽出溶媒として使用されます。
- 接着剤: 靴や皮革の製造に使用される接着剤配合物の成分として使用されます。
- コーティング: 塗料やラッカーの配合だけでなく、コーティングやワニスの製造にも使用されます。
- 分析化学: 高速液体クロマトグラフィー (HPLC) およびガスクロマトグラフィー (GC) 分析の移動相溶媒として使用されます。
質問:
Q: テトラヒドロフランを過剰な HBr で処理すると生成される主な有機生成物は何ですか?
A: THF を過剰の HBr で処理すると、形成される主な有機生成物は 3-ブロモ-1,4-ジオキサンです。
Q: テトラヒドロフランは水と混和しますか?
A: はい、THF は水と混和します。極性溶媒、特に水に対して高い溶解性を持っています。
Q: テトラヒドロフランはゴムを損傷しますか?
A: はい、THF はゴムを損傷する可能性があります。ゴム素材の膨張、軟化、亀裂の原因となります。
Q: テトラヒドロフランは極性ですか、それとも無極性ですか?
A: THF は極性溶媒です。環構造に存在する酸素原子により双極子モーメントがあり、極性化合物に対する優れた溶媒となります。
Q: テトラヒドロフランは水中で爆発しますか?
A: いいえ、THF は水中では爆発しません。ただし、長期間空気にさらされると、爆発性の過酸化物を生成する可能性があります。過酸化物の生成を避けるために、適切な保管と取り扱いが必要です。
Q: テトラヒドロフランの SDS は何ですか?
A: THF SDS (安全データシート) には、THF の物理的および化学的特性、取り扱いと保管の指示、健康と安全に関する予防措置、および緊急対応手順に関する情報が記載されています。 THF を使用する場合は、SDS に記載されている情報を確認し、従うことが重要です。
