エチレンとしても知られるエチレンは、甘い香りを持つ無色の可燃性ガスです。これは化学産業に不可欠な部分であり、プラスチック、溶剤、その他の化学薬品の製造に使用されます。
| IUPACの名称 | エテン |
| 分子式 | C2H4 |
| CAS番号 | 74-85-1 |
| 同義語 | エチレン、エテン(エラー)、油性ガス、エライル、1,2-二水素エチレン |
| インチチ | InChI=1S/C2H4/c1-2/h1-2H2 |
エチレンの式
エテンの化学式は C2H4 です。エテン分子に存在する原子の数と種類を表します。この式は、反応の化学量論や特定の工業プロセスに必要なエチレンの量を決定するなど、エチレンに関係する化学反応や計算に使用されます。
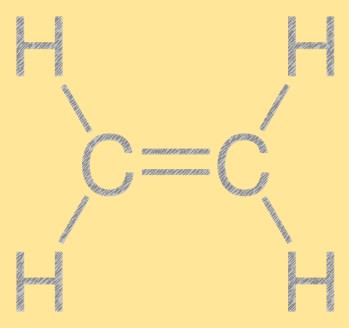
エチレン構造
エチレンは単純な直鎖構造をしており、2 つの炭素原子が二重結合で結合し、各炭素原子に 4 つの水素原子が結合しています。炭素-炭素二重結合はエチレンの反応性に関与しており、化学産業において有用な構成要素となっています。分子は平面構造をしており、すべての原子が同じ平面上にあります。
エテンモル質量
エチレンとも呼ばれるエテンのモル質量は 28.05 g/mol です。これは、化学式 C2H4 で表される、2 つの炭素原子と 4 つの水素原子で構成される単純な有機分子です。モル質量は、分子内の個々の原子の原子質量を加算することによって計算されます。
モル質量は、エチレンを含む化学反応および計算における重要なパラメータです。これは、反応に必要なエチレンの量と、生成できる生成物の量を決定するために使用されます。
エチレンの沸点
エテンの沸点は -103.7°C (-154.7°F) です。エチレンは室温および常圧で気体であり、その沸点は水よりもはるかに低いため、工業プロセスで他の物質から分離することが容易になります。
エテンの沸点は、圧力とサンプルの純度によって異なります。高圧ではエテンの沸点が上昇します。同様に、サンプル中に不純物が存在すると、沸点が期待値から変化する可能性があります。
エテンの融点
エチレンの融点は -169.2°C (-272.6°F) です。エチレンは直線状の非極性分子であり、他の多くの有機化合物に比べて比較的単純な分子です。これは融点が低いことに反映されています。
沸点と同様に、エチレンの融点もサンプルの純度によって異なります。不純物は融点を低下させ、実験目的で純粋なサンプルを入手することを困難にする可能性があります。
エチレン密度 g/ml
エチレンの密度は、0°C (32°F) および 1 気圧として定義される標準温度および圧力 (STP) 条件下で 0.958 g/mL です。エチレンは空気より密度が低いため、大気中で上昇して拡散する可能性があります。
密度は、工業プロセスで所定の空間容積に必要なエチレンの量を決定するために使用されるため、エチレンの重要な物理的特性です。サンプル中のエチレンの質量を計算するためにも使用されます。
エチレンの分子量
エチレンの分子量は 28.05 g/mol です。分子を構成する原子の原子量の合計です。分子量は、多くの化学計算、特に反応の化学量論、および必要または生成される反応物質と生成物の量を決定する際に重要なパラメーターです。
| 外観 | 無色の気体 |
| 比重 | 20°C (68°F) で 0.968 g/mL |
| 色 | 無色 |
| 匂い | 甘い、辛い |
| モル質量 | 28.05g/モル |
| 密度 | 0.958 g/mL(0℃、1気圧) |
| 融合点 | -169.2°C (-272.6°F) |
| 沸点 | 1気圧で-103.7°C (-154.7°F) |
| フラッシュドット | -136°C (-213°F) |
| 水への溶解度 | 25°C (77°F) で 3.5 g/L |
| 溶解性 | 水に不溶、有機溶剤に可溶 |
| 蒸気圧 | 20°C (68°F) で 114.6 kPa |
| 蒸気密度 | 0.97(空気=1) |
| pKa | 44 |
| pH | エチレンは水溶液ではないため適用外 |
エチレンの安全性と危険性
エチレンは引火性の高いガスで、空気と混合すると爆発性の混合物を形成する可能性があります。濃度が十分に高い場合、空気中で自然発火する可能性があります。エチレンは窒息剤でもあり、密閉空間で酸素を置換し、衝撃的な危険を引き起こす可能性があります。
液体エチレンと接触したり、高濃度のガスにさらされると、凍傷や火傷を引き起こす可能性があります。エチレンには毒性はありませんが、一酸化炭素や二酸化炭素などの燃焼生成物は人間の健康に危険を及ぼす可能性があります。
エチレンの取り扱いには、適切な換気、個人用保護具、火災安全対策などの適切な安全対策が必要です。エチレンは、発火源から離れた、換気の良い場所で保管および輸送する必要があります。
| ハザードシンボル | 可燃性ガス(GHS02)、簡易窒息剤(GHS09) |
| セキュリティの説明 | 発火源から遠ざけてください – 禁煙。火花が出ない工具のみを使用してください。ガスを吸わないでください。屋外または換気の良い場所でのみ使用してください。保護手袋/保護服/保護眼鏡/保護面を着用してください。 |
| 国連識別番号 | UN 1962 (圧縮ガス) |
| HSコード | 2901.21.00 |
| 危険等級 | 2.1 (可燃性ガス) |
| 梱包グループ | 該当なし |
| 毒性 | 無毒 |
エチレンの合成法
エチレンの合成には、炭化水素の熱分解やアルコールの脱水など、さまざまな方法が使用できます。
熱分解では、触媒の存在下でメタン、プロパン、ナフサなどの炭化水素を高温 (500 ~ 900 °C) で加熱して長鎖分子をより小さな分子に分解し、エチレンを生成します。製品。
もう 1 つの一般的な方法はアルコール脱水です。これには、アルミナやシリカなどの触媒を高温 (250 ~ 350 °C) で使用して、エタノールまたはその他のアルコールを脱水し、エチレンと水が形成されます。
スチームクラッキングはエチレンの製造に使用されるもう 1 つのプロセスであり、高温 (700 ~ 900 ℃) で炭化水素に蒸気を加えてエチレンと他の生成物の混合物を生成します。
木材、紙、プラスチックなどの有機材料の熱分解でもエチレンが発生することがあります。
エチレンを合成する他の方法には、エタンの酸化的脱水素化およびメタノールをオレフィンに変換するプロセスが含まれます。
エチレンの用途
エチレンは、幅広い用途を持つ重要な工業用化学物質です。
- エチレンは、世界で最も広く使用されているプラスチックの 1 つであるポリエチレンの製造において重要な役割を果たしています。ポリエチレンは包装、パイプ、建材などのさまざまな用途に使用されています。
- メーカーは、ポリ塩化ビニル (PVC) などの他のポリマーを製造する際の主要成分としてエチレンを使用しています。 PVC は建築材料、医療機器、電気ケーブルなどに役立ちます。
- エチレンは、洗剤、溶剤、プラスチックの製造に不可欠な原料であるエチレンオキシドの製造にも不可欠です。
- メーカーはエチレンを使用して、エンジンの冷却剤および不凍液であるエチレングリコールを製造します。ポリエステル繊維、フィルム、樹脂の製造原料としても使用されます。
- エチレンは金属の溶接や切断の燃料として使用されます。果物や野菜の熟成剤としても機能します。
- エチレンは、エタノールやアセトアルデヒドなどのさまざまな有機化合物の合成に役立ちます。
全体として、エチレンの多用途性により、エチレンは幅広い産業プロセスにおいて不可欠な成分となり、現代生活の多くの側面に貢献しています。
質問:
ディールス・アルダー反応でエチレンと反応するジエンはどれですか?
2 つの共役二重結合を含むジエンは、エテンとのディールス・アルダー反応を受ける可能性があります。このようなジエンの例には、1,3-ブタジエンおよびイソプレンが含まれる。
エテン中で水素原子はどのように配置されているのでしょうか?
エテンでは、2 つの炭素原子が二重結合によって結合されています。各炭素原子は 2 つの水素原子にも結合しており、残りの原子価は各炭素原子上の 2 つの非共有電子対によって占められています。各炭素の周りの原子の配置は三方晶系です。
エテン、C2H4 で sp2 ハイブリダイゼーションが起こると、パイ結合は何個形成されますか?
エテン中で sp2 ハイブリダイゼーションが起こると、2 つの炭素原子の間に pi 結合が形成されます。 sp2 混成軌道は炭素原子と水素原子の間のシグマ結合の形成に関与し、各炭素原子の p 軌道は重なって pi 結合を形成します。エチレンは、2 つの炭素原子の間に二重結合があるため、不飽和炭化水素として分類されます。この二重結合は 1 つのシグマ結合と 1 つのパイ結合で構成されており、エテンには同じ数の炭素原子を持つ同等の飽和炭化水素よりも水素原子が少ないことを意味します。
