アンモニウムNH4+とは何ですか?
アンモニウム イオン (NH4+) は、1 つの窒素原子と 4 つの水素原子からなる正に荷電した多原子イオンです。これは肥料や有機化合物に一般的に含まれています。
| IUPAC名 | アザニウム |
| 分子式 | NH4+ |
| CAS番号 | 14798-03-9 |
| 同義語 | アンモニウムカチオン、テトラヒドリド窒素(1+)、アミノニウム、アザニウム、水素化窒素カチオン、窒素水素、窒素イオン |
| インチチ | InChI=1S/H3N/h1H3/p+1 |
注: InChI は、単一のイオン化した水素を含む最も単純な形のアンモニウム イオンに関係します。実際の InChI は、アンモニウム イオンの化学的環境に応じて変化する可能性があります。
アンモニウム式
アンモニウムイオンの式はNH4+です。これは、1 つの窒素原子と 4 つの水素原子で構成される多原子カチオンです。アンモニウム イオンは、水素イオン (H+) によるアンモニア (NH3) のプロトン化によって形成されます。アンモニウム イオンは、肥料、医薬品、爆発物などの無機および有機化合物に含まれる一般的な陽イオンです。
アンモニウムカチオン
NH4+ としても知られるアンモニウム カチオンは、1 つの窒素原子と 4 つの水素原子で構成される正に帯電した多原子イオンです。アンモニア (NH3) が酸からプロトン (H+) を受け取り、アンモニウム塩が形成されるときに形成されます。
アンモニウムイオンのモル質量
アンモニウムイオン (NH4+) のモル質量は 18.04 g/mol です。この値は、1 つの窒素原子 (14.01 g/mol) と 4 つの水素原子 (それぞれ 1.01 g/mol) の原子量を加算することによって計算されます。モル質量はアンモニウムイオンの重要な特性です。なぜなら、アンモニウムイオンの質量をモルに変換したり、その逆に変換したりできるからです。これは、化学反応に必要な反応物の量を決定するなど、多くの化学計算に役立ちます。
アンモニウムイオンの沸点
アンモニウムイオンは通常、塩化アンモニウム(NH4Cl)などの塩の中に存在するため、それ自体の沸点はありません。代わりに、塩化アンモニウムの沸点 (520 °C) は、アンモニウム イオンと塩化物イオンの間のイオン結合の強さ、アンモニウム イオンのサイズや形状などのさまざまな要因に影響されます。
アンモニウムイオンの融点
アンモニウムイオンは純粋な形で存在する物質ではないため、沸点と同様に融点がありません。ただし、硝酸アンモニウム (NH4NO3) などのアンモニウム イオンを含む塩の融点は 169.6°C です。硝酸アンモニウムの融点は、アンモニウムイオンと硝酸イオンの間のイオン結合の強さ、および化合物の結晶構造によって影響されます。
アンモニウムイオンの密度 g/ml
アンモニウム イオン (NH4+) は多原子イオンであり、独立した存在として存在しないため、アンモニウム イオン (NH4+) の密度は適用できません。ただし、硫酸アンモニウム (NH4)2SO4 などのアンモニウム イオンを含む塩の密度は、室温で 1.77 g/cm3 です。アンモニウムイオンを含む塩の密度は、イオンのサイズと形状、イオン結合の強さ、化合物の結晶構造など、さまざまな要因の影響を受けます。
アンモニウムイオンの分子量
アンモニウム イオン (NH4+) の分子量は、1 つの窒素原子と 4 つの水素原子の原子量を加算することによって計算され、18.04 g/mol です。分子量はアンモニウムイオンの重要な特性です。なぜなら、分子量によってアンモニウムイオンの質量からモルへの変換、またはその逆の変換が可能になるからです。これは、化学反応に必要な反応物の量を決定するなど、多くの化学計算に役立ちます。
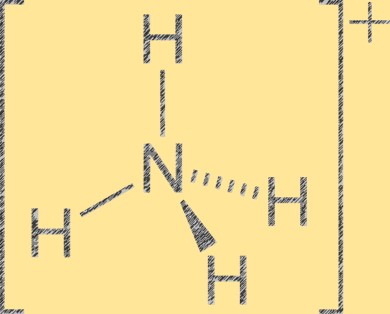
アンモニウムイオンの構造
アンモニウム イオン (NH4+) は、中心に 1 個の窒素原子、四面体の隅に 4 個の水素原子を持つ四面体の分子構造を持っています。窒素原子は +1 の正の形式電荷を持ち、各水素原子は -1 の形式電荷を持ちます。アンモニウム イオンは、水素イオン (H+) によるアンモニア (NH3) のプロトン化によって形成される多原子陽イオンです。アンモニウム イオンは、肥料、医薬品、爆発物などの無機および有機化合物に含まれる一般的な陽イオンです。
| 外観 | 白色または無色の結晶性固体ガス |
| 比重 | 該当なし(多原子イオン) |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 18.04g/モル |
| 密度 | 該当なし (多原子イオン)、塩密度は変化します (例: 硫酸アンモニウムの場合は 1.77 g/cm3)。 |
| 融合点 | 該当なし(多原子イオン)、塩の融点は異なります(例:硝酸アンモニウムの場合は169.6℃) |
| 沸点 | 該当なし (多原子イオン)、塩の沸点は変化します (例: 塩化アンモニウムの場合は 520 °C) |
| フラッシュドット | 該当なし(多原子イオン) |
| 水への溶解度 | 水に非常に溶けやすい(完全に混和する) |
| 溶解性 | アルコールおよび液体アンモニアに可溶 |
| 蒸気圧 | 該当なし(多原子イオン) |
| 蒸気密度 | 該当なし(多原子イオン) |
| pKa | 9.25 (共役酸、アンモニウムカチオン) |
| pH | 7 (中性) 水溶液中 |
注: 表に示されている値は、アンモニウム イオンの化学形態および特定の条件によって異なる場合があります。
アンモニウムイオンの安全性と危険性
アンモニウムイオンは、純粋な形では一般に安全で無毒であると考えられています。ただし、多くの化合物と同様、アンモニウム イオンは、特に不適切に扱われたり使用されたりした場合、特定の危険やリスクを引き起こす可能性があります。アンモニウムイオンは、強塩基または強酸と反応すると、有毒なアンモニアガスを放出する可能性があります。また、熱や炎にさらされると、火災や爆発の危険が生じる可能性があります。さらに、高濃度のアンモニウムイオンまたはその誘導体にさらされると、目、皮膚、呼吸器系に炎症を引き起こす可能性があります。潜在的な危険を避けるために、適切な安全プロトコルに従い、アンモニウム イオンとその誘導体を慎重に取り扱うことが重要です。
| ハザードシンボル | 純粋なアンモニウムイオンには割り当てられていません |
| セキュリティの説明 | 飲み込んだり、吸入したり、皮膚から吸収されたりすると有害です。皮膚、目、気道に刺激を与えます。有毒なアンモニアガスが発生する可能性があります。火災や爆発の危険が生じる可能性があります。 |
| ID | 3077 (アンモニウム塩を含むアンモニウム化合物用) |
| HSコード | 2827.10.00 (塩化アンモニウム、炭酸アンモニウムおよびその他のアンモニウム塩用) |
| 危険等級 | アンモニウム化合物は9類(その他危険物及び危険物)、水酸化アンモニウム溶液は8類(腐食性物質) |
| 梱包グループ | III(アンモニウム化合物用) |
| 毒性 | 一般に、純粋な形では無毒であると考えられていますが、有毒なアンモニアガスを放出する可能性があります。アンモニウム化合物および誘導体は、その特定の特性や用途によっては、人間の健康や環境に有毒または有害となる可能性があります。 |
アンモニウムイオンの合成方法
アンモニウムイオンは、化学反応や生物学的プロセスを含むさまざまな方法を使用して合成できます。
アンモニウムイオンを合成する一般的な方法は、アンモニアガスを塩酸や硫酸などの酸と反応させてアンモニウム塩を生成することです。この反応には、アンモニア分子による酸中の水素イオン (H+) の置換が含まれ、その結果、アンモニウムカチオン (NH4+) と対応する酸のアニオン (塩化物、硫酸塩など) が形成されます。得られたアンモニウム塩を精製し、結晶化させてアンモニウムイオンを得ることができる。
微生物による有機物の分解などの生物学的プロセスによっても、アンモニウムイオンが生成されることがあります。このプロセス中に、窒素含有化合物が細菌や他の微生物によって分解され、アンモニアが生成され、最終的にはアンモニウム イオンが生成されます。このプロセスはアンモン化として知られており、窒素サイクルの重要なステップです。
アンモニウムイオンを合成する別の方法は、高圧および高温で触媒の存在下で窒素ガスと水素ガスを反応させるハーバー・ボッシュ法を使用する方法です。結果として生じるアンモニアガスは酸と反応してアンモニウムイオンを生成します。
アンモニウムイオンの用途
アンモニウム イオンは、工業、農業、実験室の環境でさまざまな用途に使用されます。
これは主に農業における肥料として機能し、土壌のpHを低下させながら植物にすぐに利用できる窒素を提供するため、工業、農業、実験室の幅広い環境に役立ちます。
化学産業では、肥料、爆薬、医薬品などのさまざまな化合物の製造や、抗生物質やその他の医薬品の合成の主要成分としてアンモニウム イオンが使用されています。アンモニウムイオンは硝酸アンモニウムの形で爆発物としても機能します。
研究室では、研究者はアンモニウム イオンを沈殿反応や有機合成などの多くの化学反応の反応物質として、また溶液の pH を安定させる緩衝剤として使用します。
さらに、アンモニウムイオンは細菌や真菌を殺す能力があるため、家庭用洗剤に抗菌剤として使用されています。
アンモニウム イオンはさまざまな用途に使用でき、その多用途性により、さまざまな産業や用途において不可欠な化合物となっています。
