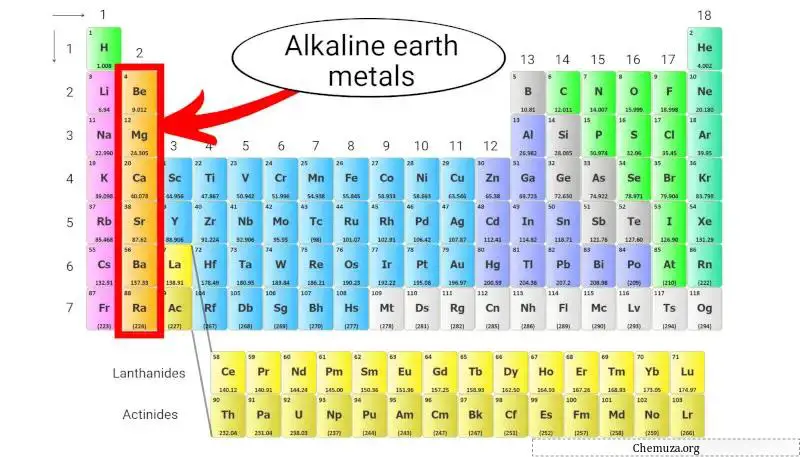
アルカリ土類金属は、周期表の 2 列目に位置する元素のグループです。それらには、ベリリウム(Be)、マグネシウム(Mg)、カルシウム(Ca)、ストロンチウム(Sr)、バリウム(Ba)、ラジウム(Ra) が含まれます。
これらの金属は最外殻に 2 つの電子を持っているため[1] 、化学的に反応性になりますが、最初の列にあるアルカリ金属ほど反応性はありません。
周期表上のアルカリ土類金属について詳しく見てみましょう。
アルカリ土類金属とは何ですか?

アルカリ土類金属は周期表の第 2 族に属し、2 つの特別な特性を持っています。
- これらが水と反応すると、本質的にアルカリ性または塩基性の水酸化物が生成されます。
- その酸化物鉱物(BeO、マグネサイト、MgO、ベリルなど)は主に地殻に存在し、熱に対して安定です。
説明
アルカリ土類金属 (Mg、Ca、Sr、Ba、Ra) が水と反応すると、本質的にアルカリ性 (または塩基性) の水酸化物を形成します。 [2]
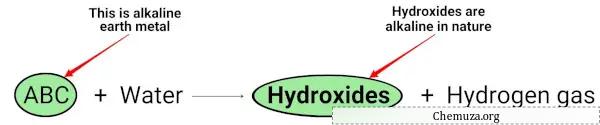
上記の化学方程式では、アルカリ金属が本質的に塩基性の水酸化物 (pH > 7 を持つ) を生成し、水素ガスを放出することがわかります。
例えば:
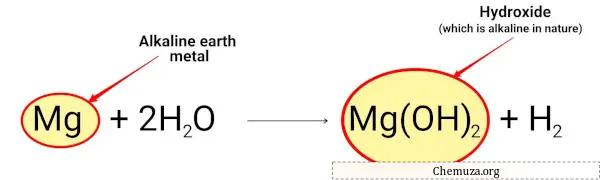
マグネシウムは水と反応してアルカリ性の水酸化マグネシウムを形成します。
さらに、これらの金属は主に地殻中に(酸化物として)存在し、これらの酸化鉱物は熱に安定です。 [2]
これら 2 つの基準により、これらの金属に「アルカリ土類金属」という名前が付けられます。
(注:第 2 族元素でもあるベリリウムは、水と反応してもアルカリ溶液を形成しないことに注意することが重要です。代わりに、その水酸化物は両性挙動を示します。つまり、酸または塩基のように振る舞うことができます。したがって、ベリリウムは同じグループに属していてもアルカリ土類金属とはみなされません。)
すべてのアルカリ土類金属に共通するものは何ですか?
アルカリ土類金属にはいくつかの共通の特徴があります。
たとえば、それらはどちらもその最外エネルギー準位に2 つの価電子を持っているため、非常に反応性が高くなります。
この反応性は、化学反応中にこれらの電子を失う傾向があり、その結果、電荷 +2 のカチオンが形成されるためです。
さらに、すべてのアルカリ土類金属は光沢のある銀白色の外観を持っています。

つまり、これらはアルカリ土類金属に共通する 2 つの主な点です。
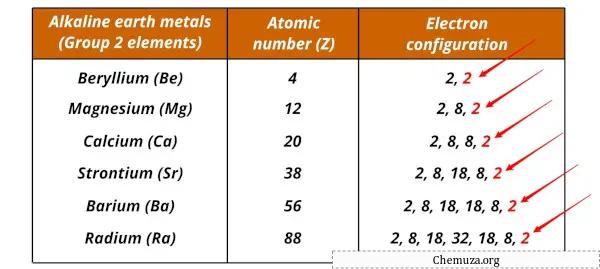
アルカリ金属とその電子配置のリスト
アルカリ土類金属とその電子配置を以下に示します。
| 要素 | 電子構成 |
| ベリリウム(Be) | [彼] 2秒2 |
| マグネシウム(Mg) | [実行] 3 秒2 |
| カルシウム(Ca) | [Ar] 4秒2 |
| ストロンチウム(Sr) | [Kr] 5秒2 |
| バリウム(Ba) | [Xe] 6秒2 |
| ラジウム (Ra) | [Rn] 7秒2 |
アルカリ土類金属の周期的傾向
周期表のアルカリ土類金属族の下に移動すると、次の傾向が観察されます。
- 価数:すべてのアルカリ土類金属は同じ +2 の価数を持ちます。したがって、グループが下に進んでも価数に変化はありません。
- 原子サイズ:アルカリ土類金属の原子サイズは、グループが下になるほど大きくなります。これは、電子層(または軌道)の数が増加し、内部電子の遮蔽効果によって原子核と最外殻電子の間の引力が減少するためです。
- 金属的性質:アルカリ土類金属の金属的性質は、グループが下になるほど増加します。これは、原子が大きくなり、より多くの電子が含まれるようになり、電子を失いやすくなり、陽イオンが形成されやすくなるからです。
- 電気陰性度:アルカリ土類金属の電気陰性度は、グループが下になるほど減少します。これは、原子が大きくなり、より多くの電子殻を持つようになり、電子を引き寄せることが難しくなるためです。
- 電子親和力:アルカリ土類金属の電子親和力は一般に低く、下位のグループになるほど減少します。
- イオン化エネルギー:アルカリ土類金属のイオン化エネルギーは、下位の族になるほど減少します。これは、原子が大きくなると電子殻が多くなり、最も外側の電子が原子核から遠く離れて除去されやすくなるからです。
まとめ
アルカリ土類金属には、ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウムが含まれます。最外殻には電子が 2 つあるため、反応性は高くなりますが、アルカリ金属ほどではありません。
これらの金属は水と反応するとアルカリ水酸化物を生成し、熱に安定な酸化鉱物を含みます。すべてのアルカリ土類金属に共通する主な特徴は、価電子を 2 つ持ち、銀白色で光沢があり、+2 の電荷を持つ陽イオンを形成することです。
原子価はグループの下に移動しても同じままですが、原子サイズと金属的性質が増加し、電気陰性度、電子親和力、およびイオン化エネルギーが減少します。
