亜硝酸ナトリウム (NaNO2) は、バクテリアの増殖を防ぎ、ベーコンやホットドッグなどの加工肉の色と風味を高める食品保存料として一般的に使用される化合物です。
| IUPAC名 | 亜硝酸ナトリウム |
| 分子式 | NaNO2 |
| CAS番号 | 7632-00-0 |
| 同義語 | 亜硝酸、ナトリウム塩; E250;亜硝酸ナトリウム;亜硝酸ナトリウム;亜硝酸ナトリウム;国連 1500 |
| インチチ | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
亜硝酸ナトリウムの性質
亜硝酸ナトリウムの処方
亜硝酸ナトリウムの化学式はNaNO2です。これは、1 モルの亜硝酸ナトリウムには、1 つのナトリウム カチオン、1 つの窒素原子、および 2 つの酸素原子が含まれていることを示します。この式は物質の組成を表すために使用され、物質が受ける可能性のある反応を予測するために使用できます。
亜硝酸ナトリウムのモル質量
NaNo2 のモル質量は 69.0 g/mol です。これは NaNo2 1 モルの質量であり、化合物の個々の分子 6.02 x 10^23 を含む物質の量です。モル質量は、物質のさまざまな化学的および物理的特性を計算するために使用される重要な物理的特性です。
亜硝酸ナトリウムの沸点
NaNo2 の沸点は 320°C (608°F) です。これは、NaNo2 が液体から気体に変化する温度です。沸点は、染料、顔料、医薬品の製造など、さまざまな産業用途で物質がどのように使用されるかに影響を与える可能性があるため、重要な特性です。
亜硝酸ナトリウム 融点
NaNo2 の融点は 271°C (520°F) です。これは、NaNo2 が固体から液体に変化する温度です。融点は、さまざまな温度での物質の安定性と反応性に影響を与える可能性があるため、重要な特性です。
亜硝酸ナトリウムの密度 g/mL
NaNo2 の密度は 2.168 g/mL です。密度は物質の単位体積あたりの質量であり、溶液の濃度を決定するために使用できます。 NaNo2 の密度は、サンプルの純度を決定するために使用することもできます。
亜硝酸ナトリウムの分子量
NaNo2 の分子量は 69.0 g/mol です。これは、化合物の分子内のすべての原子の原子量の合計です。分子量は、物質のさまざまな化学的および物理的特性を計算するために使用される重要な特性です。
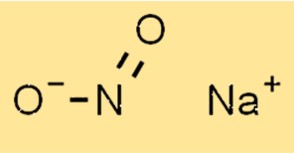
亜硝酸ナトリウムの構造
NaNo2 の構造は、ナトリウムカチオン (Na+) と亜硝酸アニオン (NO2-) で構成されます。亜硝酸アニオンは、1 つの窒素原子と 2 つの酸素原子を含む三方晶系の平面形状を持っています。ナトリウムカチオンは亜硝酸アニオンの中心に位置します。
亜硝酸ナトリウムの溶解度
NaNo2 は水に可溶で、20℃での溶解度は 820 g/L です。溶解度は、特定の温度で特定の量の溶媒に溶解できる物質の最大量です。 NaNo2 の溶解度は、温度や他の溶質の存在などの要因によって影響を受ける可能性があります。
| 外観 | 白色〜微黄色の結晶粉末 |
| 比重 | 2,168g/mL |
| 色 | 白色~やや黄色みがかった色 |
| 匂い | 無臭 |
| モル質量 | 69.0g/モル |
| 密度 | 2,168g/mL |
| 融合点 | 271°C (520°F) |
| 沸点 | 320°C (608°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 820g/L(20℃) |
| 溶解性 | エタノールおよびグリセロールに可溶 |
| 蒸気圧 | 1.33 kPa(20℃) |
| 蒸気密度 | 2.3 (空気 = 1) |
| pKa | 3.34 |
| pH | 7-8 (10%溶液) |
亜硝酸ナトリウムの安全性と危険性
NaNo2 は人間の健康と環境に多くの危険をもたらす可能性があります。摂取、吸入、または皮膚から吸収された場合は有毒であると考えられており、血液が体の組織に酸素を運ぶことができない状態であるメトヘモグロビン血症を引き起こす可能性があります。 NaNo2 は目、皮膚、呼吸器系を刺激する場合もあります。 NaNo2 は、適切な個人用保護具を使用し、適切な取り扱いおよび廃棄手順に従って慎重に取り扱うことが重要です。さらに、NaNo2 は、適切に封じ込めて処分しないと環境にリスクをもたらす可能性があります。
| ハザードシンボル | T+、C |
| セキュリティの説明 | 可燃物から遠ざけてください。粉塵、煙霧、ガス、ミスト、蒸気、スプレーを吸入しないでください。保護手袋/衣類と目/顔を保護するものを着用してください。火災の場合: CO2、化学粉末または泡を使用して消火してください。内容物/容器は、地域/地域/国家/国際規制に従って廃棄してください。 |
| 国連識別番号 | UN1500 |
| HSコード | 283410 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 経口摂取、吸入、皮膚吸収により非常に有毒です。メトヘモグロビン血症を引き起こす可能性があります。目、皮膚、呼吸器系を刺激します。 |
亜硝酸ナトリウムの合成方法
NaNo2 を合成するにはいくつかの方法があります。
一般的な方法は、硝酸と水酸化ナトリウムを反応させて硝酸ナトリウムを生成することです。鉄や亜鉛などの還元剤は硝酸ナトリウムを還元し、NaNo2 を形成します。
別の方法では、硝酸ナトリウムと塩酸を反応させ、硝酸と塩化ナトリウムの混合物を生成します。水酸化ナトリウムは硝酸と反応してNaNo2を生成します。
NaNo2 の合成は、アンモニアと硝酸ナトリウムの反応によって起こり、生成物として NaNo2 と水が生成されます。
硝酸の製造プロセスでは、アンモニアが酸化される際に副生成物として NaNo2 が生成されます。
亜硝酸ナトリウムの用途
NaNo2 はさまざまな業界でさまざまな用途に使用されており、その一部には次のようなものがあります。
- 食品の保存: 食品の保存料として、特にベーコンやホットドッグなどの加工肉に一般的に使用されます。有害な細菌の増殖を防ぎ、肉の色と風味を保ちます。
- 産業用途: 金属加工や腐食防止剤など、さまざまな産業用途で使用されます。染料やその他の化学薬品の製造にも使用されます。
- 医療用途: ヘモグロビンをメトヘモグロビンに変換し、シアン化物イオンと結合してヘモグロビンへの結合を防ぐことができるため、シアン化物中毒の治療に医学的に使用されます。
- 水処理: 水システム内の有害な細菌や藻類の増殖を制御するために水処理に使用されます。
- 農業: 農業で肥料として使用され、作物の収量と品質の向上に役立ちます。
- 写真: 写真の現像剤として使用されます。
質問:
Q: 亜硝酸ナトリウムとは何ですか?
A: NaNo2 は、式 NaNO2 の化合物です。これは白色またはわずかに黄色がかった結晶性の粉末で、食品保存料として、またさまざまな工業用途で一般的に使用されています。
Q: 亜硝酸ナトリウムを発見したのは誰ですか?
A: NaNO2 は、1805 年にフランスの化学者ルイ・ニコラ・ヴォークランによって初めて発見されました。
Q: 亜硝酸ナトリウムは体に悪いですか?
A: NaNo2 の過剰摂取は人間の健康に害を及ぼす可能性があります。これは、がんやメトヘモグロビン血症などの健康上の問題と関連しています。メトヘモグロビン血症は、血液が酸素を効果的に輸送できない病気です。ただし、規制され、限られた量で使用される場合、NaNo2 は消費しても安全であると考えられます。
Q: 亜硝酸ナトリウムの式は何ですか?
A: 亜硝酸ナトリウムの式は NaNO2 です。
Q: 亜硝酸ナトリウムは安全ですか?
A: 一般に、NaNo2 は、規制され、限られた量で使用される場合、消費しても安全であると考えられています。しかし、過剰摂取は人間の健康に害を及ぼす可能性があります。
Q: 亜硝酸ナトリウムはどうやって作るのですか?
A: NaNo2 は、硝酸と水酸化ナトリウムの反応、硝酸ナトリウムと塩酸の反応、アンモニアと硝酸ナトリウムの反応など、さまざまな方法で合成できます。ただし、NaNo2 の合成には危険な化学物質が使用され、適切な安全対策が必要となるため、慎重に行う必要があります。
Q: 亜硝酸ナトリウムは酸化剤ですか?
A: はい、NaNo2 は酸化剤です。酸化剤として火工品でよく使用されます。
Q: 亜硝酸ナトリウムは肉の色にどのような影響を与えますか?
A: NaNO2 は、ベーコンやホットドッグなどの塩漬け肉の食品保存料として一般的に使用されています。変色の原因となる有害な細菌の増殖を抑制し、肉の色を保つのに役立ちます。
Q: NaNO2 と NaNO3 はどのようにして商業的に生産されますか?
A: NaNO3 および NaNO2 は、アンモニアの酸化や水酸化ナトリウムと硝酸の反応など、さまざまな方法で商業的に製造されています。これらは、食品の保存だけでなく、さまざまな産業、医療、農業用途で使用されています。
