塩化ナトリウム (NaCl) は、ナトリウムイオンと塩素イオンから構成される化合物です。それは一般に食卓塩と呼ばれ、食品の味付けや食品の保存に使用されます。
| IUPAC名 | 塩化ナトリウム |
| 分子式 | 塩化ナトリウム |
| CAS番号 | 7647-14-5 |
| 同義語 | 岩塩、岩塩、食塩水、海塩 |
| インチチ | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
塩化ナトリウムの配合
塩化ナトリウムの化学式は NaCl で、ナトリウムイオン (Na+) と塩化物イオン (Cl-) の組み合わせを表します。式は化合物内の原子またはイオンの相対数を示し、その組成を簡単に識別して表現できるようになります。
NaClのモル質量
食塩とも呼ばれる塩化ナトリウムのモル質量は 58.44 g/mol です。これは、1 モルの塩化ナトリウムに 58.44 グラムの化合物が含まれていることを意味します。モル質量は、化合物中のナトリウム (Na) と塩素 (Cl) の原子質量を加算することで計算され、それぞれ 22.99 g/mol と 35.45 g/mol になります。
塩化ナトリウムの沸点
塩化ナトリウムはイオン結合のため、沸点が 1,413 °C (2,575 °F) と高くなります。加熱すると、エネルギー入力によりナトリウムイオンと塩化物イオンの間のイオン結合が切断され、化合物の相が固体状態から液体状態に変化します。塩化ナトリウムの沸点は、イオン間に強い静電引力があるため、他の多くの化合物よりも高くなります。
塩化ナトリウムの融点
塩化ナトリウムの融点は 801°C (1474°F) です。沸点と同様に、融点が高いのも、ナトリウムイオンと塩化物イオン間の強いイオン結合によるものです。加熱すると、入力されたエネルギーがイオンを保持する静電力に打ち勝ち、化合物が固体から液体の状態に遷移します。
塩化ナトリウムの密度 g/ml
塩化ナトリウムの密度は、室温 (25°C または 77°F) で 2.165 g/mL です。密度は、物質の単位体積あたりの質量の尺度です。塩化ナトリウムの高密度は、その原子の緻密な配置と、ナトリウムイオンと塩化物イオン間の強いイオン結合によるものです。
塩化ナトリウムの分子量
前述のように、塩化ナトリウムの分子量は 58.44 g/mol です。分子量は、分子内のすべての原子の原子量を加算することによって計算されます。塩化ナトリウムは伝統的な意味では分子として存在しませんが、その分子量は式単位 NaCl に基づいて計算されます。
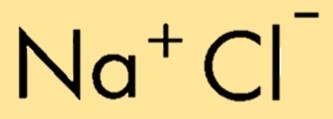
塩化ナトリウムの構造
塩化ナトリウムは、ナトリウムイオンと塩化物イオンが 1:1 の比率で規則的に配列した結晶構造を持っています。構造は面心立方格子で、各ナトリウム イオンが 6 つの塩化物イオンに囲まれ、各塩化物イオンが 6 つのナトリウム イオンに囲まれています。塩化ナトリウムのイオン結合により、非常に安定で壊れにくいネットワーク構造が形成されます。
| 外観 | 白色の結晶固体 |
| 比重 | 2.165 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 58.44 g/モル |
| 密度 | 2,165g/ml |
| 融合点 | 801°C (1474°F) |
| 沸点 | 1,413°C (2,575°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 359 g/L(20℃) |
| 溶解性 | 水およびグリセロールに可溶。エタノールとアセトンに不溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 7 |
| pH | 7 (ニュートラル) |
塩化ナトリウムの安全性と危険性
塩化ナトリウム (NaCl) は一般に、人間が消費および使用するのに安全であると考えられています。ただし、高濃度の NaCl にさらされると、目、皮膚、気道に炎症を引き起こす可能性があります。大量の NaCl を摂取すると、脱水症状、電解質の不均衡、さらには死に至る可能性があります。塩化ナトリウムは、可燃性物質と接触すると火災や爆発の危険を引き起こす可能性もあります。事故を防ぐためには、適切な取り扱いと保管が必要です。 NaCl の取り扱いおよび使用の際は、損傷のリスクを最小限に抑えるために、適切なガイドラインと安全上の注意事項に従うことが重要です。
| ハザードシンボル | なし |
| セキュリティの説明 | 飲み込んだり吸入すると有害です。皮膚や目の炎症を引き起こします。 |
| 国連識別番号 | 国連 7646 |
| HSコード | 2501.00.90 |
| 危険等級 | 無毒 |
| 梱包グループ | 適用できない |
| 毒性 | LD50 (経口、ラット) – 3,000 mg/kg |
塩化ナトリウムの合成方法
塩化ナトリウムは岩塩鉱山や海水などさまざまな供給源から供給されますが、化学反応を通じて実験室で合成することも可能です。
塩化ナトリウムを合成する一般的な方法には、塩酸 (HCl)と水酸化ナトリウム (NaOH)を反応させることが含まれます。この反応では、副生成物として塩化ナトリウムと水が生成されます。この反応の方程式は次のとおりです。
HCl + NaOH → NaCl + H2O
別の方法では、炭酸ナトリウム (Na2CO3) を塩酸 (HCl) と反応させて、塩化ナトリウム、二酸化炭素、水を生成します。この反応の方程式は次のとおりです。
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
ナトリウムと塩素ガスの反応は、塩化ナトリウムを合成するそのような方法の 1 つです。この反応には、高温と、望ましくない副生成物の形成を避けるための慎重な制御が必要です。この反応の方程式は次のとおりです。
2Na + Cl2 → 2NaCl
化学者は、コスト、試薬の入手可能性、最終生成物の望ましい純度や収率などの要因に基づいて、塩化ナトリウム合成方法を修正または変更することを選択する場合があります。これらの方法により、天然源が稀であっても確実に塩化ナトリウムを生産できます。
塩化ナトリウムの用途
食塩としても知られる塩化ナトリウムは、さまざまな産業や用途で多くの用途があります。塩化ナトリウムの一般的な用途には次のようなものがあります。
- 食品産業: スナック、加工肉、焼き菓子などのさまざまな食品の調味料および風味増強剤として使用されます。
- 医療産業: 体の体液と電解質を補充するための静脈内溶液やその他の医療処置に使用されます。
- 化学産業: 塩素、水酸化ナトリウム、炭酸ナトリウムなどのさまざまな化学物質の製造に使用されます。
- 水処理:不純物を取り除き、飲料水に適した水にするための処理に使用されます。
- 農業: 特に土壌に必須栄養素が不足している地域で、作物の肥料として使用されます。
- 防氷剤:冬季の道路や歩道の滑りやすい路面による事故を防ぐための防氷剤として使用されます。
- 繊維産業: ナイロンやポリエステルなどの合成繊維の製造に使用されます。
- 石油およびガス産業: 石油およびガスの掘削および抽出に使用されます。
- 家畜: 健康な成長と発育を促進するための家畜の栄養補助食品として使用されます。
これらは、塩化ナトリウムのさまざまな用途のほんの一例です。その汎用性と入手しやすさにより、幅広い業界の多くの製品やプロセスに不可欠な成分となっています。
質問:
Q: 塩化ナトリウムは化合物ですか?
A: はい、塩化ナトリウムは化合物です。
Q: 塩化ナトリウムはイオン性ですか、それとも共有結合性ですか?
A: 塩化ナトリウムはイオン性化合物です。
Q: 塩化ナトリウムとは何ですか?
A: 塩化ナトリウムは、化学式 NaCl の白色の結晶性化合物です。それは一般に食卓塩と呼ばれ、人間と動物の栄養にとって不可欠です。
Q: 塩化ナトリウムは何に使われますか?
A: 塩化ナトリウムは、食品の調味料や風味増強剤、医療、化学生産、水処理、凍結防止剤、繊維製品や石油など、さまざまな産業や用途で多くの用途があります。ガス、家畜の飼料サプリメントとして。
Q: 塩化ナトリウムは水に溶けますか?
A: はい、塩化ナトリウムは水によく溶けます。
