ヒドラジンまたは N2H4 は、窒素と水素から構成される無色の反応性の高い化合物です。ロケット推進剤、医薬品、農薬、化学反応の還元剤として使用されます。
| IUPAC名 | ヒドラジン |
| 分子式 | N2H4 |
| CAS番号 | 302-01-2 |
| 同義語 | ジアミン;ジアザン;水素化窒素;無水ヒドラジン;無水ヒドラジン;水酸化ヒドラジニウム;ヒドラジン水和物。メチルヒドラジン;対称ヒドラジン |
| インチチ | InChI=1S/H4N2/c1-2/h2H,1H2 |
ルイス構造 N2H4:
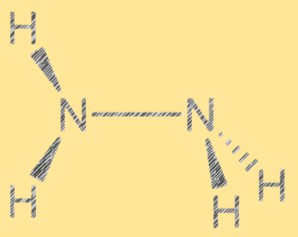
ヒドラジンのルイス構造は、分子内の電子の配置を示します。この構造は、それぞれ 1 対の自由電子を持つ 2 つの窒素原子と 4 つの水素原子で構成されています。 2 つの窒素原子は単共有結合で結合しており、各窒素原子は 2 つの水素原子にも結合しています。ヒドラジンのルイス構造は、その反応性と特性を説明するのに役立ちます。
化合物N2H4の名前:
化合物N2H4の名前はヒドラジンです。名前の由来は、ヒドラジンが水素原子と窒素原子を含む化合物であることに由来しています。ヒドラジンは、ジアミン、ジアザン、水素化窒素など、さまざまな別名でも知られています。
N2H4 モル質量:
分子式 N2H4 のヒドラジンのモル質量は 32.04 g/mol です。 2 つの窒素原子と 4 つの水素原子からなる比較的軽い化合物です。ヒドラジンは分子量が低いため、高い推力対重量比が得られ、ロケット燃料として一般的に使用される理由の 1 つです。
ヒドラジンの沸点:
ヒドラジンの沸点は、大気圧で 113.5 °C (236.3 °F) です。この沸点の低さは、ヒドラジンが蒸発しやすいことを意味しており、取り扱いが危険になる可能性があります。ヒドラジンは加熱すると窒素ガスと水素ガスに分解する可能性があり、これも危険です。
ヒドラジンの融点:
ヒドラジンの融点は -51.7 °C (-61.06 °F) です。これは、ヒドラジンが室温および常圧で液体であることを意味します。また、融点が低いため、低温で固まりやすく、取り扱いが難しくなる場合があります。
ヒドラジンの密度 g/ml:
ヒドラジンの密度は、室温および常圧で 1.00 g/mL です。これは、ヒドラジンが水よりわずかに密度が高く、同じ条件下での密度が 1.00 g/mL であることを意味します。
ヒドラジンの分子量:
ヒドラジンの分子量は 32.04 g/mol です。この値は、化学反応やその他の用途で必要なヒドラジンの量を計算するために使用されます。
ヒドラジンの構造:
ヒドラジンの構造は、単共有結合で結合した 2 つの窒素原子で構成され、各窒素原子は 2 つの水素原子にも結合しています。これにより、ヒドラジンに対称的な V 字型の分子構造が与えられます。ヒドラジンの構造は、その反応性と特性において重要な役割を果たします。
ヒドラジンの式:
ヒドラジンの化学式は N2H4 です。この式は、ヒドラジンが 2 つの窒素原子と 4 つの水素原子で構成されていることを示しています。この式は、化学方程式および化学反応においてヒドラジンを表すために使用されます。
| 外観 | 無色~淡黄色の液体 |
| 比重 | 1.00g/ml |
| 色 | 無色 |
| 匂い | アンモニア臭 |
| モル質量 | 32.04g/モル |
| 密度 | 1.00g/ml |
| 融合点 | -51.7°C (-61.06°F) |
| 沸点 | 113.5°C (236.3°F) |
| フラッシュドット | 38°C (100°F) |
| 水への溶解度 | 混和性 |
| 溶解性 | エタノール、ジエチルエーテル、クロロホルムに可溶 |
| 蒸気圧 | 20℃で72mmHg |
| 蒸気密度 | 1.0 (空気=1) |
| pKa | 8 |
| pH | 塩基性 (pH > 7) |
ヒドラジンの安全性と危険性
ヒドラジンは反応性が高く危険な化合物であり、慎重な取り扱いと保管が必要です。有毒であり、皮膚、目、粘膜に接触すると重度の火傷を引き起こす可能性があります。ヒドラジン蒸気を吸入すると、呼吸器への刺激や肺の損傷を引き起こす可能性があり、極端な場合には死に至る可能性があります。ヒドラジンは可燃性でもあり、特に酸化剤などの特定の物質と接触すると容易に発火する可能性があります。これらの危険性があるため、ヒドラジンを取り扱うときは、適切な安全予防措置と個人用保護具を使用する必要があり、適切な安全訓練を受けた資格のある専門家が換気の良い場所でのみ使用する必要があります。
| ハザードシンボル | どくろ、炎 |
| セキュリティの説明 | 換気の良い場所でのみ使用してください。手袋、衣類、目/顔を保護するものを着用してください。皮膚、目、衣類との接触を避けてください。熱、火花、炎から遠ざけてください。 |
| 国連識別番号 | 国連2030 |
| HSコード | 282510 |
| 危険等級 | 6.1 (有毒物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 経口摂取、吸入、皮膚との接触は非常に有毒です。重度の火傷や組織損傷を引き起こす可能性があります。長期にわたる曝露は肝臓や腎臓に損傷を引き起こす可能性があり、発がん性がある可能性があります。 |
ヒドラジンの合成法
ヒドラジンは、所望の純度および特定の用途に応じて、さまざまな方法で合成できます。ヒドラジンを合成する一般的な方法は次のとおりです。
- ラシヒ法: この方法には、銅やニッケルなどの触媒の存在下でのアンモニアと次亜塩素酸ナトリウムの反応が含まれます。
- オリン・ラシヒプロセス: このプロセスには、尿素と塩酸を反応させてヒドラジン水和物を生成することが含まれます。
- ケタジンプロセス: このプロセスには、ラネーニッケルなどの触媒の存在下でのアセトンとアンモニアの反応が含まれます。
- 過酸化物プロセス: このプロセスには、白金やパラジウムなどの触媒の存在下での過酸化水素とアンモニアの反応が含まれます。
- バイヤープロセス: このプロセスには、銅やニッケルなどの触媒の存在下での次亜塩素酸ナトリウムと尿素の反応が含まれます。
- Houben-Hoesch 反応: この反応には、亜鉛などの還元剤の存在下での亜硝酸とアンモニアの反応が含まれます。
各方法には独自の長所と短所があり、方法の選択はコスト、収率、純度、安全性の考慮事項などの要因によって決まります。ヒドラジンは危険物質であり、正しく取り扱わないと人間の健康と安全に危険を及ぼす可能性があるため、ヒドラジン合成は注意して行う必要があります。
ヒドラジンの用途
N2H4 は、その独特の化学的特性により、産業、商業、軍事の幅広い用途に使用されています。 N2H4 の一般的な用途には次のようなものがあります。
- 企業は、エネルギー含有量と安定性が高い N2H4 をロケット燃料として使用しています。
- N2H4 は、ナイロンやケブラーなどの特定のポリマーの製造において重合剤として使用されます。
- 化学者は、化学合成反応、特に医薬品、殺虫剤、その他の有機化合物の製造において、還元剤として N2H4 を使用します。
- N2H4 は、金属メッキプロセス、特にニッケルメッキにおいて還元剤として機能します。
- 水処理プラントでは、特にボイラーや冷却塔で脱酸素剤として N2H4 が使用されています。
- 写真家は、特に白黒写真において、写真現像剤として N2H4 を使用します。
- 自動車メーカーは、自動車エアバッグ システムのインフレーターとして N2H4 を信頼しています。
- 業界では、特にエレクトロニクス産業において、特定の機器や表面の洗浄剤として N2H4 を使用しています。
ヒドラジンには多くの有用な用途がありますが、危険物質でもあるため、取り扱いには注意が必要です。ヒドラジンを取り扱うときは、適切な安全予防措置と個人用保護具を使用する必要があり、適切な安全訓練を受けた資格のある専門家のみが使用する必要があります。
質問:
N2H4のNの酸化数(酸化状態)は何ですか?
N2H4 では、N の酸化数(酸化状態)は -2 です。各水素原子の酸化数は +1 であり、N2H4 は中性分子であるため、すべての原子の酸化数の合計は 0 に等しくなければなりません。 N2H4 には窒素原子が 2 つあるため、分子内の窒素の合計酸化数は -4 になります。したがって、各窒素原子の酸化数は -2 となり、水素原子の酸化数と釣り合います。
化合物N2H4の名前は何ですか?
化合物 N2H4 は一般にヒドラジンと呼ばれます。
ヒドラジン (n2h4) と過酸化水素 (h2o2)、およびヒドラジンと水のモル比はどれくらいですか?
ヒドラジン (N2H4) と過酸化水素 (H2O2) のモル比、およびヒドラジンと水のモル比は、それぞれの反応の平衡化学式から決定できます。
ヒドラジンが過酸化水素と反応すると、次の平衡式に従って窒素ガス (N2)、水 (H2O)、酸素ガス (O2) が生成されます。
N2H4 + H2O2 → N2 + 2H2O + O2
この式によれば、ヒドラジンと過酸化水素のモル比は 1:1 となります。これは、反応に使用されるヒドラジン 1 モルごとに、1 モルの過酸化水素が消費されることを意味します。
ヒドラジンが水と反応すると、化学式 N2H4・H2O を持つヒドラジン水和物が形成されます。この反応の平衡化学式は次のとおりです。
N2H4 + H2O → N2H4・H2O
この式によれば、ヒドラジン/水のモル比は 1:1 となります。これは、反応に使用されるヒドラジン 1 モルごとに 1 モルの水が消費され、1 モルのヒドラジン水和物が生成されることを意味します。
