酸化マグネシウム (MgO) は、建築材料や栄養補助食品として使用される白色の粉末状の固体です。塩基性(アルカリ性)特性により、制酸剤としても使用されます。
| IUPAC名 | 酸化マグネシウム |
| 分子式 | MgO |
| CAS番号 | 1309-48-4 |
| 同義語 | マグネシア、マグネサイト、ペリクレース |
| インチチ | InChI=1S/MgO/c1-2 |
酸化マグネシウムの配合
酸化マグネシウムの化学式はMgOです。マグネシウムイオン(Mg2+)と酸素イオン(O2-)を表します。この式は、化合物に存在する元素の比率を示し、酸化マグネシウムが関与する反応のバランスの取れた化学方程式を記述するために使用されます。
酸化マグネシウムのモル質量
酸化マグネシウムのモル質量は 40.304 g/mol です。化合物に存在する各元素の原子量を加算することで計算されます。マグネシウムの原子量は 24,305 g/mol、酸素の原子量は 16,000 g/mol です。モル質量は、酸化マグネシウムの所定のサンプル中に存在する物質の量を決定する際に重要です。
酸化マグネシウムの沸点
酸化マグネシウムの沸点は2852℃です。この温度では、固体の蒸気圧は大気圧と等しくなり、沸騰し始めます。酸化マグネシウムの沸点が高いのはそのイオン性によるもので、格子構造内のイオンを分離するには大量のエネルギーが必要です。
酸化マグネシウムの融点
酸化マグネシウムの融点は2800℃です。この温度では、固体は液体に状態を変えます。酸化マグネシウムの融点が高いのは、そのイオン性とネットワーク構造におけるイオン間の強い結合によるものでもあります。
酸化マグネシウムの密度 g/mL
酸化マグネシウムの密度は 3.58 g/mL です。この値を使用して、特定の質量の酸化マグネシウムが占める空間の量を決定できます。これは化合物の特徴的な特性であり、さまざまな用途に役立ちます。
酸化マグネシウムの分子量
酸化マグネシウムの分子量は 40,304 g/mol です。これは、化合物に存在する各元素の原子量の合計です。分子量は、酸化マグネシウムの所定のサンプル中に存在する物質の量を決定する際に重要です。
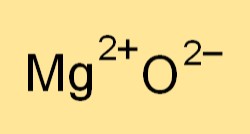
酸化マグネシウムの構造
酸化マグネシウムは、マグネシウムイオンが酸素イオンに囲まれた結晶格子構造を持っています。マグネシウムイオンと酸素イオンは強いイオン結合によって結合されており、これが化合物の高い融点と沸点に寄与しています。結晶構造は、酸化マグネシウムの密度や熱伝導率などの特性を決定する重要な要素です。
| 外観 | 白い粉末状の固体 |
| 比重 | 3.58g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 40.304 g/モル |
| 密度 | 3.58g/ml |
| 融合点 | 2800℃ |
| 沸点 | 2852℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 不溶性 |
| 溶解性 | 酸に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | アルカリ性(塩基性) |
酸化マグネシウムの安全性と危険性
酸化マグネシウムは一般に、推奨用量で人間が摂取しても安全であると考えられており、栄養補助食品や制酸剤として使用されています。しかし、高濃度の酸化マグネシウムの粉塵を吸入すると呼吸器への刺激を引き起こす可能性があり、長期間暴露すると肺の損傷を引き起こす可能性があります。酸化マグネシウムを大量に摂取すると、下痢、吐き気、腹部の不快感を引き起こす可能性があります。酸化マグネシウムは、粉塵の吸入を避けるため、乾燥した換気の良い場所に保管することが重要です。炎症を引き起こす可能性があるため、酸化マグネシウムが皮膚や目に付着しないようにしてください。すべての化学物質と同様に、酸化マグネシウムを扱うときは、怪我のリスクを最小限に抑えるために、適切な取り扱いと安全手順に従うことが重要です。
| ハザードシンボル | 該当なし |
| セキュリティの説明 | S26-S36/37/39 |
| 国連識別番号 | UN3077、環境有害物質、固体、NOS(酸化マグネシウム) |
| HSコード | 2825.90.90 |
| 危険等級 | 9 |
| 梱包グループ | Ⅲ |
| 毒性 | 推奨用量で摂取した場合は毒性が低いが、高濃度で吸入すると呼吸器刺激を引き起こす可能性がある |
酸化マグネシウムの合成方法
酸化マグネシウム (MgO) は、熱分解、沈殿、ゾルゲル法などのいくつかの方法で合成できます。
焼成としても知られる熱分解では、炭酸マグネシウムまたは水酸化マグネシウムを高温で加熱して MgO を生成します。この方法は、耐火材料の製造や、製薬および化学産業向けの高純度 MgO の合成に一般的に使用されています。
沈殿は MgO を合成するもう 1 つの方法です。この方法では、塩化マグネシウムや硫酸マグネシウムなどのマグネシウム塩と、水酸化ナトリウムや水酸化カリウムなどのアルカリ溶液を反応させて、MgO を形成します。沈殿した MgO を濾過、洗浄、乾燥させて純粋な生成物を得ることができます。
ゾルゲルプロセスには、マグネシウムアルコキシドなどのマグネシウム前駆体の加水分解と縮合が含まれ、MgO が形成されます。この方法には、均一な粒径と明確な結晶構造を備えた MgO を製造できるという利点があり、触媒、セラミック、エレクトロニクス産業での用途に役立ちます。
全体として、MgO を合成する方法は、MgO 製品の目的の用途だけでなく、所望の純度、粒子サイズ、結晶構造によって異なります。合成方法に関係なく、不純物の生成を回避し、高品質の MgO 製品を得るために反応条件を注意深く制御することが重要です。
酸化マグネシウムの用途
酸化マグネシウム(酸化マグネシウム)は、化学的安定性、高い熱伝導性、電気絶縁性を備えているため、幅広い用途に使用されています。酸化マグネシウムの最も一般的な用途には次のようなものがあります。
- 酸化マグネシウム (MgO) は、その化学的安定性、高い熱伝導性、電気絶縁性により幅広い用途に使用されています。
- 建築および建設業界では、MgO を耐火材料として、また耐火材料の製造に使用しています。
- 製薬業界では、MgO を栄養補助食品および胃酸を中和する制酸剤として使用しています。
- MgO は、水酸化マグネシウムや炭酸マグネシウムなどの他のマグネシウム化合物の製造におけるマグネシウム源として機能します。
- 化学産業では、合成ゴム、プラスチック、樹脂の製造などのさまざまな反応で触媒として MgO が使用されています。
- 農業産業では、土壌の肥沃度を改善し、植物の成長に必須のマグネシウムを供給するための土壌改良剤として MgO が使用されています。
- MgO は重金属や有毒物質を吸着する能力があるため、環境修復に役立ちます。
- セラミック産業では、セラミック、電気絶縁体、耐火物、高温断熱材の製造の原料として MgO を使用しています。
- エレクトロニクス産業では、誘電率が高く損失正接が低いため、コンデンサやトランジスタなどの電子デバイスの製造に MgO が使用されています。
全体として、酸化マグネシウムは、化学的特性と物理的特性のユニークな組み合わせにより、多くの用途に使用できる多用途の材料です。
質問:
酸化マグネシウムのような化合物を最もよく表すものは何ですか?
酸化マグネシウム (MgO) はイオン化合物として形成されます。
金属マグネシウムは非金属酸素に電子を与え、正に帯電したマグネシウムイオン (Mg2+) と負に帯電した酸化物イオン (O2-) を生成します。これらのイオンは強い静電引力によってイオン結合し、その結果固体の結晶構造が形成されます。
イオン性化合物は、高い融点と沸点、室温での固体性、溶融状態または溶解状態での良好な導電性、およびほとんどの溶媒に対する不溶性を示します。これらの特性により、イオン性化合物は、共有結合によって形成され、融点と沸点が低く、導電性が低く、多くの溶媒に溶解しにくい分子化合物とは区別されます。
建築材料として使用されるイオン性化合物は何ですか?石灰岩塩 酸化マグネシウム 酸化鉄
塩石灰石はイオン性化合物ではありませんが、酸化マグネシウムと酸化鉄はイオン性化合物です。
酸化マグネシウム(MgO)と酸化鉄は建築材料として使用されます。 MgO は耐火壁や隔壁を形成し、高温用途の耐火材料の成分として機能します。ヘマタイトとしても知られる酸化鉄は、レンガ、コンクリート、セラミックに顔料として赤茶色を与えます。ヘマタイトは化学反応の触媒としても機能し、さまざまな技術で磁性材料として機能します。
