ギ酸または HCOOH は、刺激臭のある無色の液体です。防腐剤や抗菌剤として、また皮革、繊維、ゴムの製造に広く使用されています。
| IUPAC名 | メタン酸 |
| 分子式 | ひこー |
| CAS番号 | 64-18-6 |
| 同義語 | カルボン水素酸、ホルミル酸、アミノ酸、ホルミル酸、メタ炭酸、チオニルギ酸など |
| インチチ | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
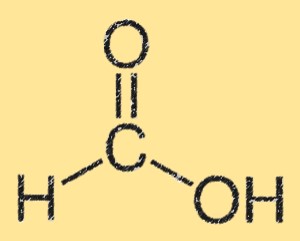
ギ酸の構造
ギ酸の構造は、単一の炭素原子にカルボン酸基 (-COOH) が結合していることが特徴です。炭素原子は水素原子および酸素原子とも結合しています。ギ酸の構造は平面的で、カルボン酸基間に水素結合があります。水素結合により、水への高い溶解度が生じます。
ギ酸の配合
ギ酸の化学式は HCOOH です。これは、炭素原子 1 つ、酸素原子 1 つ、水素原子 2 つを含む単純な有機化合物です。ギ酸の式は、その化学的および物理的特性、およびさまざまな条件下での挙動を決定する上で重要です。化学量論やモル濃度などのさまざまな化学計算にも使用されます。
ルイス構造 HCOOH
ギ酸 (HCOOH) のルイス構造は次のとおりです。
H
|
C=O
|
おお
炭素原子は構造の中心にあり、4 つの価電子を持っています。 2 つの水素原子と 2 対の自由電子を持つ酸素原子と単結合を形成します。酸素原子は他の炭素原子とも二重結合を形成し、一対の自由電子を運びます。ルイス構造は、炭素原子と酸素原子の電気陰性度の違いにより、分子が極性の共有結合を持っていることを示しています。
ギ酸モル質量
メタン酸とも呼ばれるギ酸のモル質量は 46.03 g/mol です。その化学式は HCOOH で、炭素原子 1 つ、酸素原子 1 つ、水素原子 2 つが含まれていることを示します。モル質量は、特定の濃度の溶液を調製するために必要な物質の量を決定するための重要なパラメータです。たとえば、ギ酸の 1 M 溶液を調製するには、46.03 g のギ酸を 1 リットルの溶媒に溶解する必要があります。
ギ酸の沸点
HCOOH の沸点は 100.8°C (213.4°F) です。刺激臭のある無色の液体で、水によく溶けます。 HCOOH の沸点は比較的低いため、容易に蒸発および蒸留できます。この特性により、染料、プラスチック、医薬品の製造など、さまざまな産業用途に役立ちます。
HCOOH 融点
HCOOH の融点は 8.4°C (47.1°F) です。室温では固体ですが、融点以下に冷却することで純粋な形で得られます。 HCOOH の結晶は白く、刺激臭を発します。 HCOOH の融点は他のカルボン酸に比べて比較的低いため、特定の化学反応の溶媒として役立ちます。
HCOOH 密度 g/mL
HCOOH の密度は 25°C (77°F) で 1,220 g/mL です。同じ温度での密度が 1000 g/mL である水よりも密度が高くなります。 HCOOH の密度は、水やその他の溶媒への溶解度を決定する重要な特性です。これは、温度や圧力などのさまざまな条件下での動作にも影響します。
ギ酸の分子量
ギ酸の分子量は 46.03 g/mol です。これは、化学式 HCOOH を持つ単純な有機化合物です。分子量は、物質の物理的および化学的特性を決定するための重要なパラメーターです。物質のモル数、質量、体積などのさまざまな量を計算するために使用されます。
| 外観 | 無色の液体 |
| 比重 | 1.22 |
| 色 | 無色 |
| 匂い | エーカー |
| モル質量 | 46.03g/モル |
| 密度 | 1,220g/ml |
| 融合点 | 8.4℃ |
| 沸点 | 100.8℃ |
| フラッシュドット | 68℃ |
| 水への溶解度 | 混和性 |
| 溶解性 | ほとんどの有機溶媒に可溶 |
| 蒸気圧 | 44.5mmHg |
| 蒸気密度 | 1.5 (空気=1) |
| pKa | 3.75 |
| pH | 2.4 |
ギ酸の安全性と危険性
HCOOH は、いくつかの安全性と危険性のリスクをもたらします。これは非常に腐食性が高く有毒な物質であり、接触すると重度の皮膚火傷や目の損傷を引き起こす可能性があります。 HCOOH 蒸気を吸入すると、呼吸器への刺激や肺の損傷を引き起こす可能性があります。可燃性でもあり、高温で発火し、火災の危険性があります。 HCOOH を取り扱うときは、保護服、手袋、保護眼鏡の使用など、適切な安全対策を講じる必要があります。酸化剤やアルカリなどの不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。
| ハザードシンボル | 腐食性、有毒性 |
| セキュリティの説明 | 保護手袋と目/顔の保護具を着用してください。目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。 |
| 国連識別番号 | UN1779 |
| HSコード | 2915.11.00 |
| 危険等級 | 8 (腐食性) |
| 梱包グループ | Ⅱ(中級) |
| 毒性 | LD50 1.8 g/kg (経口、ラット) |
ギ酸の合成方法
ギ酸はさまざまな方法で合成できます。
- 一般的な方法には、ロジウムやコバルトなどの触媒の存在下での一酸化炭素と水の反応が含まれます。これがFormoxプロセスです。このプロセスでは、ギ酸と水素ガスが生成されます。
- 別の方法では、酸性条件下でクロム酸や過マンガン酸カリウムなどの強力な酸化剤を使用してホルムアルデヒドを酸化します。この反応により、ギ酸と水が生成されます。
- ギ酸を合成する 1 つの方法は、ギ酸ナトリウムと硫酸を反応させることです。この反応により、副生成物としてギ酸と硫酸ナトリウムが生成されます。
- アリは自然の防御機構としてギ酸を生成し、アリの体内から蒸留によって得ることができます。
- HCOOHを合成する別の方法には、亜クロム酸銅や酸化亜鉛などの触媒の存在下で二酸化炭素を水素と反応させることが含まれます。 HCOOH 合成反応として知られるこのプロセスでは、HCOOH と水が生成されます。
- HCOOH は、少量存在するイラクサの葉などの天然源からも入手できます。
全体として、HCOOH の合成にはいくつかの方法が利用可能ですが、それぞれに長所と短所があります。
ギ酸の用途
ギ酸は、さまざまな産業で幅広い用途があります。
- ギ酸は、有害な微生物の増殖を防ぐ能力があるため、動物の飼料やサイレージの防腐剤および抗菌剤として一般的に選択されています。
- 飼料やサイレージ中の有害な微生物の増殖を防ぐのに役立ち、有用な添加物となります。
- 繊維産業では、色堅牢度を向上させ、染料の繊維への親和性を高めるために、布地の染色および仕上げ剤としてギ酸を使用しています。
- ギ酸は、酢酸、ホルムアミド、メタノールなどのさまざまな化学物質の製造における溶媒および中間体として機能します。
- ギ酸は、皮革産業で使用されるなめし剤で、皮革製品の質感と耐久性を向上させるのに役立ちます。
- ゴムの製造において、ギ酸は凝固剤として働き、加硫プロセスを助けます。
- 製薬業界では、ギ酸をワクチンの防腐剤や医療機器の消毒剤として使用しています。
- さらに、ギ酸は利尿薬や抗ヒスタミン薬などのさまざまな薬剤の製造にも応用されています。
- ギ酸は、有機合成反応における還元剤であり、重合反応における触媒です。
- ギ酸はさまざまな製品の香りを高めるのに役立ち、フレーバーやフレグランスの製造に役立ちます。
全体として、さまざまな産業におけるギ酸の用途の多様性は、その独特の特性と多用途性によるものです。
質問:
Q. ギ酸は強酸ですか?
A. ギ酸は弱酸であり、pKa 値は約 3.75 です。これは、水中では完全には解離せず、塩酸や硫酸などの強酸よりも弱い酸であることを意味します。
Q. ギ酸と酢酸はどちらが酸性ですか?
A. ギ酸は酢酸よりも酸性です。これは、酢酸中にメチル基が存在するため、共役塩基の負電荷が安定化し、解離しにくくなります。一方、ギ酸は分子サイズが小さく、電気陰性原子(酸素)が強いため、解離しやすく、より酸性になります。
Q. ギ酸はどのアリによって生成されますか?
A. ギ酸は、ワラギアリ、ヒアリ、一部の種のハリナバチなど、数種のアリによって生成されます。酸はアリの体内に蓄えられ、捕食者に対する防御機構として使用されます。脅威にさらされると、アリは針からギ酸を発射したり、体内の特殊な腺からギ酸を放出したりすることがあります。
