フルオロメタン (CH3F) は、わずかにエーテル臭のある無色の気体です。電子機器、医薬品の製造、および冷媒として使用されます。毒性はそれほどありませんが、強力な温室効果ガスを構成します。
| IUPAC名 | フルオロメタン |
| 分子式 | CH3F |
| CAS番号 | 593-53-3 |
| 同義語 | フッ化メチル、フレオン 41、ハロカーボン 41、R 41、UN 2452 |
| インチチ | InChI=1S/CH3F/c1-2/h1H3 |
フルオロメタンの性質
CH3F 沸点
CH3F の沸点は -78.4°C で、比較的低いです。このため、冷凍や空調システムなどのさまざまな用途に理想的な冷媒となります。 CH3F は沸点が低いため、エアロゾルの噴射剤としても使用されます。
CH3F モル質量
CH3F は、分子式 CH3F の化合物です。これはフッ化メチルとしても知られ、分子量は 34.03 g/mol です。 CH3F はわずかにエーテル臭のある無色の気体で、その独特の特性によりさまざまな用途に広く使用されています。
CH3F 融点
CH3F の融点は -141°C で、これも比較的低いです。融点が低いため、取り扱いや輸送が容易であり、さまざまな産業用途で人気があります。 CH3F は融点が低いため、低温用途での冷媒としての使用にも適しています。
密度 CH3F
CH3F の密度は 0.89 g/ml で、比較的低いです。これにより、密度が 1.29 g/ml である空気よりも密度が低くなります。その結果、CH3F は、漏れ検出、ガスクロマトグラフィー、気球や飛行船の揚力ガスなど、さまざまな用途で空気より軽いガスとしてよく使用されます。
CH3F 分子量
CH3F の分子量は 34.03 g/mol で、比較的低いです。これにより、取り扱いや輸送が容易な軽量コンパウンドになります。 CH3F は、その低分子量と独特の特性により、エレクトロニクスや医薬品の製造によく使用されます。
CH3Fの構造
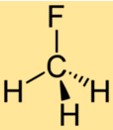
CH3F の構造は、3 つの水素原子と 1 つのフッ素原子に結合した 1 つの炭素原子から構成されます。フッ素原子は炭素原子に結合し、メタンの水素原子の 1 つを置き換えます。 CH3F の構造により、CH3F は独特の化学的特性を持つ安定した化合物になります。
フルオロメタンの配合
フルオロメタンの式は CH3F で、これは分子内の原子の配置を表します。この式は、フルオロメタンが 1 つの炭素原子、3 つの水素原子、および 1 つのフッ素原子で構成されていることを示しています。この式はフルオロメタンの化学組成を説明するために使用され、さまざまな用途で重要です。
| 外観 | 無色の気体 |
| 比重 | 20°C で 0.89 (空気 = 1) |
| 色 | 無色 |
| 匂い | 軽いエーテルの香り |
| モル質量 | 34.03g/モル |
| 密度 | 0.89g/ml |
| 融合点 | -141℃ |
| 沸点 | -78.4℃ |
| フラッシュドット | 不燃性 |
| 水への溶解度 | 0.5g/L(20℃) |
| 溶解性 | 有機溶媒に混和可能 |
| 蒸気圧 | 20℃で4.4バール |
| 蒸気密度 | 1.43 (空気 = 1) |
| pKa | 50.9 |
| pH | 適用できない |
フルオロメタンの安全性と危険性
フルオロメタンは一般に、毒性が低く、不燃性であり、取り扱いや使用が安全な化合物であると考えられています。ただし、他の化学物質と同様に、潜在的な危険性と安全性に関する考慮事項があります。高濃度のフルオロメタンに曝露すると、めまい、頭痛、吐き気を引き起こす可能性があります。また、気候変動を引き起こす強力な温室効果ガスでもあります。フルオロメタンは換気の良い場所で取り扱う必要があり、手袋やゴーグルなどの保護具を着用する必要があります。環境への漏れや偶発的な放出を避けるために、適切な保管および取り扱い手順に従うことが重要です。
| ハザードシンボル | F+ |
| セキュリティの説明 | 引火性の高いガス。吸入すると有毒。皮膚の炎症を引き起こします。深刻な目の炎症を引き起こします。眠気やめまいを引き起こす可能性があります。臓器障害を引き起こす可能性がある |
| AN識別子 | UN2452 |
| HSコード | 2903.49.90 |
| 危険等級 | 2.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 毒性は低いですが、高濃度で吸入すると健康被害を引き起こす可能性があります。 |
フルオロメタンの合成法
直接メタンフッ素化やハロゲン交換反応などのいくつかの方法でフルオロメタンを合成できます。
一般的な方法は、酸化アルミニウムやフッ化アルミニウムなどの触媒の存在下でのメタノールとフッ化水素の反応です。
別の方法には、クロロメタンまたはブロモメタンとフッ化水素ガスとの反応が含まれます。これらの方法はどちらも副生成物としてフルオロメタンを生成しますが、これは蒸留または他の方法で分離および精製できます。
フルオロメタンを合成する別の方法には、亜鉛や銅などの触媒の存在下でのフルオロホルムと塩化水素の反応が含まれます。この反応により、クロロフルオロメタンとフルオロメタンの混合物が生成され、蒸留によって分離および精製できます。
フルオロメタンの用途
フルオロメタンは、さまざまな業界で次のような用途に使用されます。
- 冷凍:沸点が低く、不燃性であるため、産業用および商業用冷凍システムの冷媒として使用されます。
- エレクトロニクス: 電子部品の洗浄剤として、また半導体産業ではプラズマ エッチング剤として使用されます。
- 医療用途: 毒性が低く、即効性があるため、獣医学の麻酔薬として使用されます。
- 農薬の生産: 除草剤や殺虫剤などの特定の農薬の生産の前駆体として使用されます。
- ポリマーの製造: ポリウレタンフォームなどのポリマーフォームの製造における発泡剤として使用されます。
- 実験室での用途: 化学合成や分析など、さまざまな実験室での用途で溶媒および試薬として使用されます。
- 消火剤: 特定のタイプの消火器、特にコンピューター室や通信室で使用される消火器の消火剤としても使用されます。
質問:
Q: CH3F は極性ですか、それとも無極性ですか?
A: CH3F は、中心の炭素原子の周りにフッ素原子と水素原子が非対称に配置されているため、極性分子であり、その結果、正味の双極子モーメントが生じます。
Q: CH3F には水素結合がありますか?
A: フルオロメタンには、窒素、酸素、フッ素などの電気陰性度の高い元素と結合した水素原子が含まれていないため、水素結合がありません。
Q: 最も強い分子間力を持つ化合物はどれですか: HF、CH3Cl、CH3F、HCl?
A: HF は、他の化合物の双極子間力よりも強い水素結合を形成する能力により、最も強い分子間力を持っています。
Q: N2、CO、CH3F、HCl のうち、双極子間力が最も弱いのはどれですか?
A: N2 は非極性分子であり、正味の双極子モーメントがないため、双極子間力が最も低くなります。 CO、CH3F、および HCl は極性分子であり、双極子間力を持っていますが、分子の極性が増加するため、これらの力の強さは HCl < CH3F < CO の順に増加します。
