テトラブロメタンは、化学式 CBr4 の化合物です。甘い香りを持つ無色の結晶固体で、溶剤や難燃剤として使用されます。有毒であり、人間や環境に害を及ぼす可能性があります。
| IUPAC名 | テトラブロメタン |
| 分子式 | CBr4 |
| CAS番号 | 558-13-4 |
| 同義語 | 四臭化炭素、テトラブロモホルム、ペルブロモメタン、テトラブロモメタン |
| インチチ | InChI=1S/CBr4/c2-1(3,4)5 |
テトラブロメタンの性質
モル質量 CBr4
テトラブロメタンのモル質量は約 331.63 g/mol です。他の有機分子に比べて比較的重い化合物です。テトラブロモメタンのモル質量は、分子内のすべての原子の原子質量を加算することによって決定されます。この場合、それは 1 つの炭素原子と 4 つの臭素原子で構成されます。
CBr4の沸点
テトラブロメタンの沸点は 189°C (372°F) です。これは、液体テトラブロメタンの蒸気圧が大気圧と等しくなる温度です。この温度では、液体のテトラブロモメタンが沸騰し始め、蒸発してガスになります。
CBr4の融点
CBr4 の融点は 90.5 °C (194.9 °F) です。これは、固体の CBr4 が液体の状態に変化する温度です。 CBr4 は、分子量と分子間力が大きいため、有機分子としては比較的高い融点を持っています。
密度 CBr4 g/ml
テトラブロメタンの密度は室温で 3.42 g/mL です。これは、特定の体積のテトラブロメタンの重さは、同じ体積の水の 3.42 倍であることを意味します。テトラブロメタンの高密度は、分子量が高く、原子が緻密に配置されているためです。
分子量 CBr4
テトラブロメタンの分子量は 331.63 g/mol です。分子内のすべての原子を合わせた重量です。テトラブロメタンの分子量は、その物理的特性を計算し、化学反応における挙動を理解するために重要です。
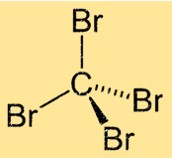
CBr4の構造
テトラブロモメタンは、中心に炭素原子があり、それに 4 つの臭素原子が結合した四面体の分子構造を持っています。この分子は、中心の炭素原子の周りに等しい角度で配置された 4 つの同一の Br-C 結合を持つ対称的な構造を持っています。この構造により、テトラブロメタンに独特の物理的および化学的特性が与えられます。
テトラブロメタンの式
テトラブロメタンの式は CBr4 です。これは、1 つの炭素原子と 4 つの臭素原子で構成されていることを意味します。テトラブロメタンの式は、その化学構造を理解し、他の分子との反応性を予測するために重要です。
| 外観 | 無色から淡黄色の結晶固体 |
| 比重 | 3.42g/ml |
| 色 | 無色~淡黄色 |
| 匂い | 柔らかい |
| モル質量 | 331.63 g/モル |
| 密度 | 3.42g/ml |
| 融合点 | 90.5°C (194.9°F) |
| 沸点 | 189°C (372°F) |
| フラッシュドット | 不燃性 |
| 水への溶解度 | 0.0032 g/100 mL(20℃) |
| 溶解性 | 水に不溶、ベンゼン、クロロホルム、二硫化炭素に可溶 |
| 蒸気圧 | 0.006 mmHg(25℃) |
| 蒸気密度 | 14.2 (対空) |
| pKa | 適用できない |
| pH | 適用できない |
テトラブロメタンの安全性と危険性
テトラブロメタンは、適切に取り扱わないと、いくつかの危険を引き起こす可能性があります。摂取、吸入、または皮膚に接触すると有害です。テトラブロメタンに曝露すると、炎症、頭痛、めまい、吐き気を引き起こす可能性があります。長期間暴露すると、肝臓や腎臓に損傷を与える可能性があります。また、環境に潜在的な危険性があるため、環境中に放出すべきではありません。テトラブロモメタンを取り扱うときは、防護服や保護具の使用を含む適切な予防措置を講じる必要があります。偶発的に暴露した場合は、直ちに医師の診察を受ける必要があります。テトラブロモメタンは、換気の良い場所で、適切な安全手順に従って保管および取り扱いする必要があります。
| ハザードシンボル | T(有毒) |
| セキュリティの説明 | 摂取したり、吸入したり、皮膚に接触させたりしないでください。保護服と保護具を着用してください。誤って暴露した場合は医師に相談してください。 |
| 国連識別番号 | 国連 2515 |
| HSコード | 2903.90.9000 |
| 危険等級 | 6.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 飲み込んだり、吸入したり、皮膚から吸収した場合は有毒です。刺激、頭痛、めまい、吐き気を引き起こす可能性があります。長期間暴露すると、肝臓や腎臓に損傷を与える可能性があります。 |
テトラブロモメタンの合成方法
テトラブロメタンを合成するには、研究者はメタンを臭素化するか、四臭化炭素を水素ガスと反応させるか、臭素をギ酸ナトリウムと反応させることができます。
メタンの臭素化には、臭化鉄や臭化アルミニウムなどの触媒の存在下でのメタンと臭素の反応が含まれます。テトラブロモメタンを得るプロセスで生じたブロモメタンの混合物を分離および精製できます。
四臭化メタンを合成するには、ニッケルなどの触媒の存在下で四臭化炭素を水素ガスと反応させます。この反応によりブロモメタンの混合物が生成され、研究者はこれを分離および精製してテトラブロモメタンを得ることができます。
テトラブロメタンを合成する別の方法には、硫酸の存在下での臭素とギ酸ナトリウムの反応が含まれます。テトラブロメタンと硫酸ナトリウムから得られる生成物を分離および精製すると、テトラブロメタンが得られます。
テトラブロメタンの用途
テトラブロメタンは、その独特の特性により、さまざまな産業でいくつかの用途があります。その用途の一部を次に示します。
- 難燃剤: プラスチック、繊維、その他の材料の難燃剤として使用されます。熱にさらされると臭素を放出することで作用し、燃焼プロセスを阻害します。
- 化学中間体: 医薬品や農薬などの他の化学物質の製造における化学中間体として使用されます。
- 溶媒: 特に殺虫剤の製造において、さまざまな有機化合物の溶媒として使用されます。
- 試験剤: 他の化学物質中の不純物を検出するための試験剤として使用されます。
- 精錬剤:アルミニウムやその他の金属の製造において精錬剤として使用されます。
- 獣医学: 動物の寄生虫感染症の治療のための駆虫薬または駆虫薬として獣医学で使用されます。
質問:
Q: CBR4 は極性ですか、それとも無極性ですか?
A: テトラブロモメタン (cbr4) は、対称四面体構造と極性結合の欠如により、無極性分子です。
Q: 次の化合物のうち、極性があるのはどれですか: cbr4、xef2、scl4、brf3、ch3oh?
A: 指定された化合物の中で、CH3OH (メタノール) と BRF3 (三フッ化臭素) だけが、非対称な分子構造と極性結合の存在により極性分子です。
Q: CBR4 は水溶性ですか?
A: テトラブロメタンは非極性であるため水に溶けず、水の極性とは相溶しません。
Q: 式 cbr4 の化合物の名前は何ですか? A: 式 cbr4 の化合物は、四臭化メタンまたは四臭化炭素と呼ばれます。
