ニトロベンゼンまたは C6H5NO2 は、淡黄色と独特の臭気を持つ有機化合物です。アニリンやその他の化学物質の製造の前駆体として使用されます。有毒物質でもあります。
| IUPAC名 | ニトロベンゼン |
| 分子式 | C6H5NO2 |
| CAS番号 | 98-95-3 |
| 同義語 | ニトロベンゾール、ニトロベンゼン、ミルバネエッセンス、NB |
| インチチ | InChI=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
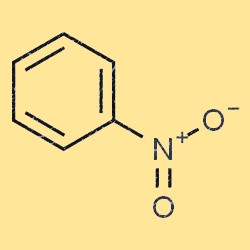
ニトロベンゼンの構造
ニトロベンゼンは平らで平面的な分子構造を持っています。これは、炭素原子の 1 つにニトロ基 (-NO2) が結合したベンゼン環 (C6H5) で構成されています。ニトロ基は電子求引性基であり、ベンゼン環の電子密度を減少させます。この特性により、ニトロベンゼンは多くの化学反応においてベンゼンよりも反応性が低くなります。
ニトロベンゼンの式
ニトロベンゼンの化学式は C6H5NO2 です。この式は、分子を構成する原子の数と種類を表します。ベンゼン環は分子の骨格を構成し、ニトロ基は化合物の特性に影響を与える極性官能基を構成します。ニトロベンゼンの式は、その化学的および物理的特性、および他の物質との反応性を理解するために重要です。
ニトロベンゼンのモル質量
C6H5NO2 とも呼ばれるニトロベンゼンのモル質量は 123.11 g/mol です。これは、化合物内のすべての原子の原子質量を加算することによって計算されます。ニトロベンゼンは、その化学構造中に 6 つの炭素原子と 1 つの窒素原子が存在するため、比較的高いモル質量を持っています。
ニトロベンゼンの沸点
ニトロベンゼンの沸点は210.9℃です。これは、同様の分子量を持つ他の有機化合物と比較して比較的高い値です。沸点が高いのは、水素結合や双極子相互作用など、ニトロベンゼン分子間に強い分子間引力が存在するためです。
ニトロベンゼンの融点
ニトロベンゼンの融点は5.85℃です。これは沸点に比べて比較的低く、これは固体状態での分子間引力が液体状態よりも弱いという事実によって説明できます。さらに、ニトロベンゼンは多形性を示すことがあり、融点の異なる複数の結晶構造で存在できることを意味します。
ニトロベンゼンの密度 g/ml
ニトロベンゼンの密度は室温 (25℃) で 1.20 g/mL です。これは、ニトロベンゼンは、同じ温度での密度が 1 g/mL である水よりも密度が高いことを意味します。ニトロベンゼンの密度は、その分子量、分子のサイズと形状の影響を受けます。
ニトロベンゼンの分子量
ニトロベンゼンの分子量は 123.11 g/mol です。これは、化合物内のすべての原子の原子質量を加算することによって計算されます。ニトロベンゼンの分子量は、沸点、融点、溶解度などの物理的および化学的特性を決定する上で重要です。
| 外観 | 淡黄色の液体 |
| 比重 | 1.20g/cm3 |
| 色 | 淡い黄色 |
| 匂い | 特性 |
| モル質量 | 123.11 g/モル |
| 密度 | 1.20 g/mL(25℃) |
| 融合点 | 5.85℃ |
| 沸点 | 210.9℃ |
| フラッシュドット | 77℃ |
| 水への溶解度 | 7.9 g/L(25℃) |
| 溶解性 | 有機溶剤に可溶 |
| 蒸気圧 | 0.68 mmHg(25℃) |
| 蒸気密度 | 4.35 (エアー=1) |
| pKa | -1.15 |
| pH | 7 (ニュートラル) |
ニトロベンゼンの安全性と危険性
ニトロベンゼンは非常に有毒な物質であり、安全性と健康上のいくつかのリスクを引き起こします。接触または吸入すると、皮膚、目、気道に炎症を引き起こす可能性があります。ニトロベンゼンに長期間曝露すると、肝臓や腎臓の損傷、貧血、メトヘモグロビン血症を引き起こす可能性があります。ニトロベンゼンは非常に可燃性が高く、比較的低温で発火する可能性があります。さらに、加熱、燃焼、または分解すると有毒なフュームが発生する可能性があります。したがって、ニトロベンゼンを慎重に取り扱い、適切な保護具を着用し、発火源や不適合物質から離れた涼しく乾燥した場所に保管することが重要です。
| ハザードシンボル | て、ん |
| セキュリティの説明 | 非常に有毒で、飲み込んだり、吸入したり、皮膚から吸収されたりすると有害で、重度の皮膚火傷や目の損傷を引き起こします。 |
| AN識別子 | UN1662 |
| HSコード | 2904.90.90 |
| 危険等級 | 6.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 非常に有毒です |
ニトロベンゼンの合成法
ニトロベンゼンは、ベンゼンのニトロ化、ニトロベンゼンの還元、ニトロベンゼンの水素化などのいくつかの方法で合成できます。最も一般的に使用される方法はベンゼンのニトロ化です。これには、ベンゼンと硝酸と硫酸の混合物を約 50°C の温度で反応させることが含まれます。ニトロ化反応では、ニトロベンゼンとベンゼンの他のニトロ誘導体の混合物が生成されます。
ニトロベンゼンを合成する別の方法はニトロベンゼン還元であり、これには鉄または亜鉛などの還元剤と塩酸の使用が含まれます。還元反応によりニトロベンゼンのニトロ基 (-NO2) がアミノ基 (-NH2) に変換され、副生成物としてアニリンが生成されます。
ニトロベンゼンの水素化は、アニリン合成の別の方法です。この方法では、ニッケルやパラジウムなどの触媒と水素ガスを使用し、ニトロベンゼンと反応させてアニリンを生成します。
ニトロベンゼンの用途
ニトロベンゼンは、幅広い用途で使用される多用途の化学物質です。
- 化学産業では、染料、ゴム、医薬品の製造における重要な成分であるアニリンの前駆体としてニトロベンゼンが使用されています。ニトロベンゼンは、プラスチック、樹脂、接着剤の製造に使用されるフェノールなどの他の化学物質を製造するための貴重な原料です。
- 油、脂肪、ワックスなどの有機化合物はニトロベンゼンを使用して溶解できるため、有用な溶媒となります。食品産業では、ニトロベンゼンは主にチューインガムの製造で香料として使用されています。
- C6H5NO2 は、TNT (トリニトロトルエン) などの爆発物の製造に不可欠な成分です。燃料添加剤として、ニトロベンゼンはガソリンのオクタン価を高めるのに役立ちます。
- C6H5NO2 は、殺虫剤や殺菌剤を含むさまざまな殺虫剤や除草剤の製造にも使用されます。
- ナイロンなどの合成繊維の製造も、必須成分としてニトロベンゼンに依存しています。
全体として、ニトロベンゼンの多用途な性質により、ニトロベンゼンは化学、食品、繊維産業を含む多くの産業において不可欠な化学物質となっています。ただし、ニトロベンゼンは毒性と引火性があるため、使用する場合は適切な取り扱いと安全上の注意が必要です。
質問:
ニトロベンゼンとアニリンの反応
ニトロベンゼンからアニリンへの変換は、ニトロ基 (-NO2) のアミノ基 (-NH2) への還元とその後の中間生成物の加水分解を含む 2 段階の反応です。
C6H5NO2 の還元は通常、鉄や亜鉛などの還元剤と塩酸などの酸性溶液を使用して行われます。この反応により中間生成物であるニトロソベンゼンが生成され、これは酸または塩基触媒の存在下でアニリンに還元されます。
ニトロソベンゼン中間体のアニリンへの加水分解は、中間体を希塩酸などの酸性溶液で処理することによって達成されます。この反応により、アニリンのほかに水と窒素酸化物 (NO) が生成されます。
全体的な反応は次のように表すことができます: ニトロベンゼン + 3 H2 → アニリン + 2 H2O + N2
