エタノールまたは C2H6O は、植物原料に由来する無色の可燃性アルコールで、バイオ燃料または溶媒としてよく使用されます。アルコール飲料にもよく使われる成分です。
| IUPAC名 | エタノール |
| 分子式 | C2H6O |
| CAS番号 | 64-17-5 |
| 同義語 | エチルアルコール、穀物アルコール、EtOH、アルコール |
| インチチ | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
エタノールの性質
ルイス構造 C2H6O
C2H6O (エタノールとしても知られる) のルイス構造は次のように描くことができます。
HH
| |
HCCOH
| |
HH
この構造では、2 つの炭素原子が単共有結合によって互いに結合されています。各炭素原子は 3 つの水素原子にも結合し、1 つの炭素原子は 1 つの酸素原子にも結合します。酸素原子は単一の共有結合によって炭素原子に結合しており、2 対の自由電子を持っています。
この構造は、分子内の各原子の価電子殻に 8 つの電子がなければならないというオクテット ルールを満たしています。炭素原子は価殻に 4 つの電子を持ち、水素原子はそれぞれ 1 つの電子を持ちます。酸素原子には 6 つの価電子があり、追加の孤立電子対が 2 つあるため、オクテット則を満たします。
C2H6O モル質量
エタノールのモル質量は約 46.07 g/mol です。物質のモル質量は、その物質 1 モルの質量として定義されます。エタノールの場合、1 モルのエタノールには約 46.07 グラムの物質が含まれます。モル質量は、物質の質量とモルの間の変換を可能にするため、化学計算において有用なパラメータです。
エタノールの沸点
エタノールの沸点は標準圧力で約 78.5°C (173.3°F) です。この比較的沸点が低いため、エタノールの蒸発が促進され、多くの工業プロセスで役立ちます。たとえば、エタノールは医薬品、香料、その他の化学物質の製造における溶媒として一般的に使用されます。
エタノールの融点
エタノールの融点は約 -114.1°C (-173.4°F) です。エタノールは融点が低いため室温で液体となり、溶媒または燃料として液体の形で一般的に使用されます。エタノールの融点は水よりも低いため、エタノールは自動車冷却システムの不凍液として使用できます。
エタノール密度 g/mL
エタノールの密度は、標準の温度および圧力で約 0.789 g/mL です。これは、1 ミリリットルのエタノールの重さが 0.789 グラムであることを意味します。エタノールの密度は、標準温度および常圧での密度が 1 g/mL である水の密度よりも低くなります。これは、エタノールが水面に浮くことを意味します。
エタノールの分子量
エタノールの分子量は約 46.07 g/mol です。分子量は、分子内のすべての原子の原子量の合計です。エタノールの場合、炭素原子 2 個、水素原子 6 個、酸素原子 1 個が含まれています。分子量は、物質の特定の質量における物質のモル数を計算するために使用されます。
エタノールの構造
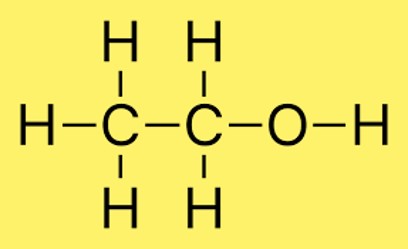
エタノールの構造では、2 つの炭素原子が単結合を介して結合し、3 つの水素原子が各炭素原子に結合します。さらに、酸素原子には水素原子が結合しています。分子内の原子の配置は一般に CH3CH2OH で表されます。
エタノール配合
エタノールの化学式は C2H6O です。この式は、分子内の原子の数と種類を示します。この式を使用して、エタノールの分子量と、物質の所定の質量中のエタノールのモル数を計算できます。この式は、他の化学物質との反応におけるエタノールの化学的挙動を予測するのにも役立ちます。
| 外観 | 無色の液体 |
| 比重 | 0.789 |
| 色 | 無色 |
| 匂い | 特有の臭気 |
| モル質量 | 46.07g/モル |
| 密度 | 0.789g/ml |
| 融合点 | -114.1°C (-173.4°F) |
| 沸点 | 標準圧力で 78.5°C (173.3°F) |
| フラッシュドット | 13℃ (55°F) |
| 水への溶解度 | 混和性 |
| 溶解性 | 極性および非極性溶媒に可溶 |
| 蒸気圧 | 44.6 kPa(20℃) |
| 蒸気密度 | 1.59 (空気 = 1) |
| pKa | 15.9~25℃ |
| pH | 7 (ニュートラル) |
エタノールの安全性と危険性
エタノールは引火性の液体であり、適切に取り扱わないと火災や爆発の危険を引き起こす可能性があります。エタノールの蒸気も容易に発火し、重大な火災の危険を引き起こす可能性があります。エタノールも摂取すると有害であり、過剰摂取はアルコール中毒を引き起こす可能性があります。大量のエタノール蒸気を吸入すると、めまい、頭痛、吐き気を引き起こす可能性があります。エタノールに長時間さらされると、皮膚の炎症や乾燥を引き起こす可能性があります。エタノールは、発火源や不適合物質から離れた、涼しく換気の良い場所に保管する必要があります。エタノールを取り扱うときは、手袋や安全メガネなどの適切な保護具を使用する必要があります。
| ハザードシンボル | F、Xi、フラム。リク。 2 |
| セキュリティの説明 | 熱、火花、裸火、高温の表面から遠ざけてください。禁煙。防爆型の電気設備、換気設備、照明設備を使用してください。蒸気の吸入を避けてください。保護手袋、保護メガネを着用してください。火災の場合: 粉末消火剤、CO2、水噴霧または泡を使用して消火してください。内容物/容器は、地域/地域/国家/国際規制に従って廃棄してください。 |
| AN識別子 | UN1170 |
| HSコード | 2207.10.00 |
| 危険等級 | 3 |
| 梱包グループ | Ⅱ |
| 毒性 | エタノールは、大量に摂取または吸入すると有毒となる可能性があります。長時間暴露すると、皮膚の炎症や乾燥を引き起こす可能性もあります。慢性的に摂取すると、アルコール依存症やその他の健康上の問題を引き起こす可能性があります。 |
エタノールの合成法
エタノールは、発酵、エチレンの直接水和、バイオマス変換などのさまざまな方法で合成できます。
発酵はエタノールを生産する最も一般的な方法であり、酵母などの微生物による糖やその他の炭水化物のエタノールへの変換が含まれます。このプロセスは、トウモロコシ、大麦、サトウキビなどの作物から、また食品廃棄物や農業残渣などの廃棄物からエタノールを製造するために使用されます。
エチレンの直接水和は、エタノールを製造する別の方法です。このプロセスでは、リン酸などの触媒の存在下でエチレンが水と反応してエタノールが形成されます。この方法は工業環境で一般的に使用されており、発酵よりも効率的です。
バイオマス変換はエタノールを生成する別の方法であり、木材チップ、草、農業残渣などの植物材料をエタノールに変換することが含まれます。このプロセスには、植物材料中のセルロースとヘミセルロースを、発酵してエタノールにできる単糖に分解することが含まれます。
エタノールを製造する他の方法には、接触二酸化炭素変換および電気化学的二酸化炭素還元が含まれる。
これらの方法にはそれぞれ長所と短所があり、どの方法を選択するかは、原材料の入手可能性、コスト、効果などの要因によって決まります。発酵は、その費用対効果と信頼性により、依然としてエタノール生産の最も広く使用されている方法です。
エタノールの用途
エタノールには、産業、商業、個人の幅広い用途があります。一般的な用途には次のようなものがあります。
- エタノールは、ガソリン添加剤として使用するとオクタン価を高め、排出量を削減します。
- エタノールは、医薬品、化粧品、パーソナルケア製品の製造に一般的に使用される多用途溶媒です。
- ビール、ワイン、スピリッツなどのアルコール飲料には有効成分としてエタノールが含まれています。
- 手指消毒剤、表面クリーナー、その他の洗浄製品には、効果的な消毒剤としてエタノールが使用されています。
- エタノールは、エッセンシャルオイル、フレーバー、その他の天然化合物の抽出における溶媒として使用されます。
- 生産者は、酢酸やエチレンなどの他の化学物質を製造するための原料としてエタノールを使用します。
- 香水、ローション、ヘアケア製品などのパーソナルケア製品には、防腐剤や芳香成分としてエタノールが使用されています。
- 化学実験室では通常、溶媒および試薬としてエタノールが使用されます。
- 自動車およびその他の冷却システムでは、不凍剤としてエタノールが使用される場合があります。
質問:
エタノール(C2H6O)の分子は何個の原子で構成されていますか?
エタノール分子 (C2H6O) は、炭素原子 2 個、水素原子 6 個、酸素原子 1 個の 9 個の原子で構成されています。
