デカン (C10H22) は、直鎖に配置された 10 個の炭素原子を含む炭化水素化合物です。洗浄や製造プロセスなど、さまざまな産業用途で溶剤として一般的に使用されています。
| IUPAC名 | デカン |
| 分子式 | C10H22 |
| CAS番号 | 124-18-5 |
| 同義語 | n-デカン、水素化デシル、n-アミルメチン、カプデカン |
| インチチ | InChI=1S/C10H22/c1-3-5-7-9-10-8-6-4-2/h3-10H2,1-2H3 |
デカンの性質
デカン式
デカンの式は C10H22 です。 10 個の炭素原子と 22 個の水素原子から構成される炭化水素化合物を表します。この式は、デカン分子に存在する原子の正確な数と種類を示しています。
デカンのモル質量
水素化デシルのモル質量は、その構成元素の原子量を加算することで計算できます。炭素 (C) のモル質量は 12.01 g/mol、水素 (H) のモル質量は 1.008 g/mol です。したがって、水素化デシルのモル質量は約 142.28 g/mol です。
デカンの沸点
デカンの沸点は約 174°C (345°F) です。これは、通常の大気圧では、水素化デシルが蒸発し始め、その温度でガス状態に変化することを意味します。沸点は水素化デシルの重要な特性であり、その物理的特性と用途を決定するために使用されます。
デカンの融点
水素化デシルの融点は約 -29°C (-20°F) です。これは、水素化デシルが固体状態から液体状態に変化する温度を意味します。この低い融点により、水素化デシルは通常の条件下で容易に液化します。
デカンの密度 g/mL
水素化デシルの密度は約 0.73 g/mL です。密度は単位体積あたりの質量の尺度です。水素化デシルの密度は、同体積の水と比較したその相対的な重さ、または軽さを示します。水素化デシルの密度が低いことは、それが水より軽いことを示唆しています。
デカンの分子量
水素化デシルの分子量は約 142.28 g/mol です。これは、水素化デシル分子内のすべての原子の原子量を加算することによって計算されます。分子量は、水素化デシル分子のサイズと質量に関する貴重な情報を提供します。
デカンの構造
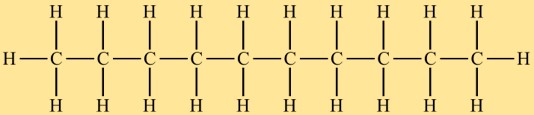
水素化デシルは、10 個の炭素原子が直線状に並んだ直鎖構造をしています。各炭素原子は周囲の水素原子と 4 つの単共有結合を形成します。水素化デシルの炭素鎖は分岐しておらず、この構造的特徴がその化学的および物理的特性に影響を与えます。
デカンの溶解度
水素化デシルは水に不溶ですが、ベンゼン、エーテル、ヘキサンなどの非極性溶媒には可溶です。その非極性の性質により、水のような極性物質との相互作用が妨げられます。水素化デシルの溶解度は、さまざまな工業プロセスや用途、特に非極性溶媒を扱う場合に重要な考慮事項です。
| 外観 | 無色の液体 |
| 比重 | 0.73 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 142.28 g/モル |
| 密度 | 0.73g/ml |
| 融合点 | -29°C (-20°F) |
| 沸点 | 174°C (345°F) |
| フラッシュドット | 43°C (109°F) |
| 水への溶解度 | 不溶性 |
| 溶解性 | ベンゼン、エーテル、ヘキサンなどの非極性溶媒に可溶 |
| 蒸気圧 | 20℃で1.22mmHg |
| 蒸気密度 | 4.88 (空気 = 1) |
| pKa | 適用できない |
| pH | 中性 |
デカンの安全性と危険性
水素化デシルには、安全上の考慮事項と危険性があります。引火性があり、裸火や火花にさらされると発火する恐れがありますので、取り扱いには十分ご注意ください。水素化デシルの蒸気は空気より重いため、地面に沿って移動して低地に蓄積し、火災や爆発の危険を引き起こす可能性があります。水素化デシルに直接接触すると、皮膚を刺激したり、目の炎症を引き起こす可能性があります。水素化デシルを扱うときは、手袋やゴーグルなどの適切な保護手段を使用することが重要です。密閉空間内の水素化デシル蒸気の濃度を最小限に抑えるには、適切な換気が重要です。
| ハザードシンボル | 可燃性 |
| セキュリティの説明 | – 裸火から遠ざけてください。 – 換気の良い場所で使用してください。 – 手袋と保護メガネを着用してください。 – 皮膚や目との直接接触を避けてください。 |
| 国連の識別子 | 国連 2247 |
| HSコード | 2901.10.00 |
| 危険等級 | クラス3(引火性液体) |
| 梱包グループ | GE II |
| 毒性 | 低毒性 |
デカンの合成方法
水素化デシルを合成するにはいくつかの方法があります。
- 水素化デシルを合成する一般的な方法は、パラジウムやニッケルなどの適切な触媒の存在下でデセンと水素ガスを反応させることです。このプロセスにより、デセンの炭素-炭素二重結合が飽和し、デシル水素化物に変換されます。
- 別の方法はエチレンオリゴマー化であり、触媒(通常は遷移金属錯体)がエチレン分子を結合させて、水素化デシルを含む高分子量の炭化水素を形成します。
- 石油精製プロセスでも水素化デシルが生成されます。このプロセスでは、原油を蒸留し、水素化デシルおよび類似の炭化水素を含む留分を分離および精製して、純粋な水素化デシルを取得します。
- フィッシャー・トロプシュ法では、高温高圧の条件下で一酸化炭素と水素を触媒、通常は鉄またはコバルト触媒上で反応させることにより、水素化デシルを合成できます。このプロセスにより、水素化デシルを含む炭化水素の混合物が生成されます。
これらの工業規模の合成方法には特殊な装置と専門知識が必要であることを強調することが重要です。合成方法の選択は、原料の入手可能性、望ましい純度、経済的考慮事項などの要因によって異なります。
デカンの用途
水素化デシルは、その特性と特性により、さまざまな産業でさまざまな用途に使用されています。水素化デシルの一般的な用途には次のものがあります。
- 溶剤: 水素化デシルは、洗浄や脱脂用途などの工業プロセスで溶剤として使用されます。さまざまな非極性物質を溶解する能力があるため、これらのプロセスで役立ちます。
- 燃料: ディーゼル燃料には成分として水素化デシルが含まれており、それを参照化合物として使用して、ディーゼル燃料の着火性を評価するセタン指数を測定します。ディーゼル燃料の燃焼特性に貢献します。
- 化学中間体: 水素化デシルは、他の化学物質を製造するための構成要素として機能します。水素化デシルは、界面活性剤、潤滑剤、ポリマーなどのさまざまな化合物の合成の原料として機能します。
- 抽出剤: 製薬業界および食品業界では、抽出剤として水素化デシルを使用しています。原材料からの特定の化合物や香りの分離と精製に役立ちます。
- 研究および実験室での用途: 科学研究および実験室では水素化デシルが使用されます。これは、ガスクロマトグラフィーの参照化合物として、また校正目的の標準として機能します。
- 化粧品配合物: 化粧品およびパーソナルケア製品には、配合物に水素化デシルが組み込まれています。さまざまなスキンケア製品やヘアケア製品において、コンディショニング剤、皮膚軟化剤、粘度調整剤として機能します。
- 工業用潤滑剤: 工業用アプリケーションでは、潤滑剤として使用することにより、水素化デシルの低揮発性と良好な潤滑性の利点が得られます。可動部品間の摩擦と摩耗を軽減します。
- 校正標準: 分析化学では、校正標準として水素化デシルを使用します。分析機器や分析技術の校正と検証を支援します。
全体として、水素化デシルの多用途な特性により、製造から研究開発に至るまで、さまざまな業界で価値があります。
質問:
Q: デカンとは何ですか?
A: 水素化デシルは、10 個の炭素原子と 22 個の水素原子で構成される分子式 C10H22 の炭化水素です。
Q: 1-デシンをデカンに還元するには、何当量の水素ガスが必要ですか?
A: 1-デシンを水素化デシルに還元するには、2 当量の水素ガスが必要です。
Q: デカンは極性がありますか?
A: いいえ、水素化デシルは、非極性の共有結合で結合した炭素原子と水素原子で構成されているため、非極性です。
Q: ヨウ素は C10H22 に溶けますか?
A: はい、ヨウ素は C10H22 (水素化デシル) に可溶です。これは、2 つの物質が無極性で混合できるためです。
Q: 次の物質のうち最も粘度が高いのはどれですか? (a) C4H10 (b) C8H18 (c) C10H22
A: C10H22 (水素化デシル) は、分子サイズが大きく炭素鎖が長いため、特定の物質の中で最も粘度が高くなります。
Q: 53.0 g の CHCl3 中の 23.0 g のデカン (C10H22) の凝固点を計算します。
A: 凝固点を計算するには、溶媒 (CHCl3) の凝固点降下定数や凝固点降下を決定するための成分のモル分率などの追加情報が必要です。
