EDTA は、金属イオンをキレートできるポリカルボン酸アミノ酸です。式は[CH2N(CH2CO2H)2]2です。体から重金属を排除するのに役立ちます。 EDTA は血液サンプルや食品も保存します。
| 名前 ユパック | 2,2′,2″,2″‘-(エタン-1,2-ジイルジアンモニア)四酢酸二ナトリウム |
| 分子式 | C10H14N2Na2O8 |
| CAS番号 | 139-33-3 |
| 同義語 | (エチレンジニトリロ)四酢酸二ナトリウム塩、エデト酸二ナトリウム、EDTA二ナトリウム、エデト酸二ナトリウム、EDTA二ナトリウム、EDTA二ナトリウム塩、エチレンビス(イミノ二酢酸)二ナトリウム塩、N,N’-1,2-エタンジイルビス[N-(カルボキシメチル) )グリシン]、二ナトリウム塩、Na2-EDTA、Na2H2EDTA |
| インチ | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
EDTAの性質
EDTA式
EDTA はエチレンジアミン四酢酸の略で、金属イオンをキレート化できる合成有機化合物です。 EDTA の式は C10H16N2O8 で、分子内に炭素原子 10 個、水素原子 16 個、窒素原子 2 個、酸素原子 8 個が含まれていることを意味します。
EDTA モル質量
エデト酸二ナトリウムのモル質量は、その式に含まれるすべての原子の原子質量の合計です。炭素、水素、窒素、酸素の原子量は、それぞれ 12.01 g/mol、1.01 g/mol、14.01 g/mol、16.00 g/mol です。 。したがって、エデト酸二ナトリウムのモル質量は、(10 x 12.01) + (16 x 1.01) + (2 x 14.01) + (8 x 16.00) = 292.24 g/mol となります。
EDTAの沸点
物質の沸点は、液体から気体に変化する温度です。エデト酸二ナトリウムの沸点は、沸点に達する前に分解してしまうため、測定が容易ではありません。ただし、一部の情報源は、エデト酸二ナトリウムの沸点を 760 mmHg の圧力で約 614.2 °C と推定しています。
EDTA 融点
物質の融点は、物質が固体から液体に変化する温度です。エデト酸二ナトリウムの融点は、水和と結晶化の程度によって異なります。エデト酸二ナトリウムの無水形態の融点は約 240℃ですが、二水和物の形態の融点は約 248℃です。
EDTA 密度 g/ml
物質の密度は単位体積あたりの質量です。エデト酸二ナトリウムの密度は水和や結晶化の程度によっても変化します。エデト酸二ナトリウムの無水形態は約 0.86 g/ml の密度を持ち、一方、二水和物形態は約 1.6 g/ml の密度を持ちます。
EDTA 分子量
物質の分子量は、物質の 1 モルの質量であるモル質量の別名です。上で述べたように、エデト酸二ナトリウムのモル質量は 292.24 g/mol であるため、その分子量も 292.24 g/mol です。
EDTAの構造
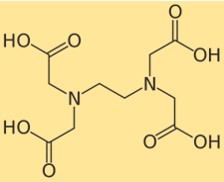
エデト酸二ナトリウムの構造は、その原子が分子内でどのように配置され、結合しているかを示します。エデト酸二ナトリウムは、中央のエチレンジアミン基に 4 つのカルボン酸基が結合しています。各カルボン酸基はプロトンを失い、負電荷を形成する可能性があり、これが金属イオンに結合する可能性があります。エデト酸二ナトリウムの構造は次の図で表すことができます。
EDTAの溶解度
物質の溶解度は、特定の温度および圧力で特定の溶媒に溶解できる量です。エデト酸二ナトリウムの溶解度は、溶液中の pH と金属イオンの存在に依存します。エデト酸二ナトリウムは、水分子と相互作用する可能性のある負電荷をより多く形成するため、酸性溶液よりもアルカリ性溶液に溶けやすくなります。エデト酸二ナトリウムは金属イオンと錯体を形成することもあり、錯体の安定性と電荷に応じて溶解度が増減することがあります。たとえば、pH 7、25 °C では、エデト酸二ナトリウムの水への溶解度は約 0.5 M (186 mg/mL) ですが、そのカルシウム複合体の溶解度は約 0.02 M (7 mg/mL) です。
| 外観 | 白色の結晶固体 |
| 比重 | 利用不可 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 292.24 g/モル |
| 密度 | 1.6 g/ml (二水和物)、0.86 g/ml (無水) |
| 融合点 | 248℃(二水和物)、240℃(無水) |
| 沸点 | 614.2℃(分解) |
| フラッシュドット | 325.2℃ |
| 水への溶解度 | 0.5 M (186 mg/ml)、pH 7、25 °C |
| 溶解性 | アルカリ溶液に可溶、有機溶剤に不溶 |
| 蒸気圧 | 3.77 x 10^-12 mmHg (25°C) |
| 蒸気密度 | 利用不可 |
| pKa | 2.0、2.7、6.2、10.3 |
| pH | 4 ~ 6 (0.26 M 溶液) |
EDTA の安全性リスク
エデト酸二ナトリウムは、金属イオンをキレート化できる合成有機化合物です。その用途は、医療、工業、農業、研究の分野で多岐にわたります。しかし、適切に取り扱わないと、人間の健康や環境に一定のリスクをもたらす可能性もあります。
エデト酸二ナトリウムは皮膚や目に接触すると炎症を起こす可能性があります。また、摂取すると吐き気、嘔吐、下痢、腹痛を引き起こす可能性があります。吸入すると呼吸器系に悪影響を及ぼす可能性があります。体内に吸収されると、血球や腎臓に影響を与える可能性があります。大量に摂取すると致命的になる可能性があります。
エデト酸二ナトリウムも環境中に放出されると土壌や水を汚染する可能性があります。それは必須金属に結合し、植物や動物の利用可能性に影響を与える可能性があります。金属イオンに依存する生物学的プロセスを妨げる可能性があります。
エデト酸二ナトリウムは、適切な保護具を着用し、慎重に使用してください。涼しく乾燥した換気の良い場所に保管してください。地域の規制に従って廃棄してください。
| ハザードシンボル | |
| セキュリティの説明 | S24/25: 皮膚や目との接触を避ける |
| 国連識別番号 | UN3077(固体)、UN3082(液体) |
| HSコード | 29224985 |
| 危険等級 | 9(各種危険物) |
| 梱包グループ | Ⅲ(危険性が低い) |
| 毒性 | 経口LD50ラット: 2000 mg/kg |
EDTA の合成方法
エデト酸二ナトリウムを合成するにはいくつかの方法がありますが、最も一般的なのは、エチレンジアミンとクロロ酢酸またはそのナトリウム塩との縮合です。
この反応には 2 つのステップが含まれます。まず、クロロ酢酸またはそのナトリウム塩に対するエチレンジアミンの求核攻撃により、モノアミド中間体が形成されます。第二に、塩酸または塩化ナトリウムを除去すると、カルボン酸基が形成されます。エデト酸二ナトリウムを形成するには、別の当量のクロロ酢酸またはそのナトリウム塩と反応させます。
エデト酸二ナトリウムを合成する別の方法は、アルカリ溶液中での次亜塩素酸ナトリウムによるエチレンジアミンの酸化です。この方法では、ナトリウム塩としてエデト酸二ナトリウムが生成され、副生成物としてアンモニアが生成されます。
エデト酸二ナトリウムを合成する他の方法には、エチレンジアミンとホルムアルデヒドおよびシアン化ナトリウムとの反応、またはエチレンジアミンとグリオキシル酸またはそのエステルとの反応が含まれる。
EDTAの用途
エデト酸二ナトリウムは、金属イオンをキレート化できる合成有機化合物です。さまざまな分野や産業でさまざまな用途に使用されています。エデト酸二ナトリウムの用途には次のようなものがあります。
- 医学では、エデト酸二ナトリウムは有毒金属と結合して体から除去することで重金属中毒を治療します。また、カルシウムイオンをキレートすることにより、血栓や動脈の石灰化を防ぐこともできます。
- 食品や飲料において、エデト酸二ナトリウムは酸化や腐敗を防ぎ、製品の色、風味、質感を保つことができます。金属イオンによる変色や劣化も防ぐことができます。
- 化粧品やパーソナルケアにおいて、エデト酸二ナトリウムは微生物の増殖や金属触媒反応を防ぐことで製品の安定性と有効性を向上させることができます。また、水の硬度に関与するミネラルをキレート化することにより、製品の外観と感触を改善することもできます。
- 産業および研究において、エデト酸二ナトリウムは、妨害金属イオンをキレート化することにより、製品およびプロセスの性能と品質を向上させることができます。たとえば、ボイラーやパイプ内のスケールの形成を防ぎ、繊維の染色や印刷を改善し、金属から錆や汚れを除去し、分析方法での pH や金属濃度を制御できます。
質問:
Q: EDTAとは何ですか?
A: エデト酸二ナトリウムは、金属イオンをキレート化できる合成有機化合物です。エチレンジアミン四酢酸の略です。
Q: EDTA 溶液はどのように調製しますか?
A: エデト酸二ナトリウム溶液を調製するには、必要な量のエデト酸二ナトリウムを秤量し、蒸留水に溶解します。水酸化ナトリウムでpHを8.0に調整します。
Q: EDTA を水に溶かすにはどうすればよいですか?
A: エデト酸二ナトリウムは水に溶けますが、ゆっくりと溶けます。エデト酸二ナトリウムを水に溶解するには、水を約 80°C に加熱し、エデト酸二ナトリウムが完全に溶解するまで混合物をかき混ぜます。
Q: 0.5M EDTA はどのように準備しますか?
A: 0.5M エデト酸二ナトリウムを調製するには、73.06 g のエデト酸二ナトリウムを秤量し、800 ml の蒸留水に溶解します。水酸化ナトリウムでpHを8.0に調整し、蒸留水で溶液を1Lに希釈します。
Q: EDTA は何をするのですか?
A: エデト酸二ナトリウムは金属イオンと結合し、金属イオンと安定した錯体を形成します。これにより、金属イオンが他の物質と反応したり、分析方法に干渉したりするのを防ぎます。
Q: EDTA とはどういう意味ですか?
A: エデト酸二ナトリウムとは、エチレンジアミン四酢酸を意味し、式 [CH2N(CH2CO2H)2]2 の化合物の名前です。
Q: EDTA 滴定によって水の硬度を計算するにはどうすればよいですか?
A: エデト酸二ナトリウム滴定によって水の硬度を計算するには、適切な指示薬を使用して、既知量の水サンプルを標準エデト酸二ナトリウム溶液で滴定します。使用したエデト酸二ナトリウムの量を記録し、次の式を使用します。 硬度 (CaCO3 として mg/L) = (EDTA の体積 x EDTA のモル濃度 x 1000) / 水サンプルの体積
