硝酸バリウム (Ba(NO3)2) は白色の固体です。水に溶けてバリウムイオンと硝酸イオンを生成します。加熱したり燃料と混合すると爆発する可能性があります。
| IUPACの名称 | 硝酸バリウム |
| 分子式 | Ba(NO3)2 |
| CAS番号 | 10022-31-8 |
| 同義語 | 硝酸バリウム、二硝酸バリウム、二硝酸バリウム、CQ9625000、(ニトロオキシ)バリオ硝酸塩 |
| インチチ | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
硝酸バリウムの性質
硝酸バリウムの配合
硝酸バリウムの分子式は Ba(NO3)2 です。これは、硝酸バリウム分子が 1 つのバリウム原子と 2 つの硝酸分子から構成されていることを示しています。硝酸イオンは -1 の電荷を持ち、バリウム イオンは +2 の電荷を持っているため、これらは 1:2 の比率で結合して中性の化合物を形成します。
硝酸バリウムのモル質量
Ba(NO3)2 のモル質量は 261.337 g/mol です。これは、1 モルの Ba(NO3)2 分子の質量です。これを計算するには、すべての原子の原子質量を式に追加する必要があります。
Ba(NO3)2 のモル質量 = (1 x 137.327) + (2 x 14.007) + (6 x 15.999) = 261.337 g/mol
硝酸バリウムの沸点
Ba(NO3)2 の沸点は 83°C です。これは、Ba(NO3)2 が液体状態から気体状態に変化する温度です。ただし、Ba(NO3)2 は沸点に達する前に分解してしまうため、他の物質に分解せずに沸騰させることはできません。
硝酸バリウム 融点
Ba(NO3)2 の融点は 592°C です。これは、Ba(NO3)2 が固体から液体に変化する温度です。 Ba(NO3)2 は室温常圧では白色の結晶固体ですが、融点以上に加熱すると溶けます。
硝酸バリウムの密度 g/ml
Ba(NO3)2 の密度は 3.23 g/ml です。これは、Ba(NO3)2 の単位体積あたりの質量です。これを計算するには、Ba(NO3)2 サンプルの質量をその体積で割る必要があります。
Ba(NO3)2 の密度 = 質量 / 体積
たとえば、Ba(NO3)2 の 10 g サンプルがあり、その体積が 3.1 ml の場合、その密度は次のようになります。
Ba(NO3)2 の密度 = 10 / 3.1 = 3.23 g/ml
硝酸バリウムの分子量
Ba(NO3)2 の分子量はそのモル質量と同じで、261.337 g/mol です。これは、1 モルの Ba(NO3)2 分子の質量です。分子量という用語はモル質量と同じ意味で使用されることがありますが、それらはまったく同じではありません。分子量は物質の分子の平均質量を指し、モル質量は物質のモルの質量を指します。
硝酸バリウムの構造
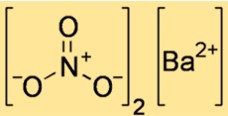
Ba(NO3)2 の構造は、原子とイオンが空間内でどのように配置されているかを示します。 Ba(NO3)2 はイオン性化合物であり、正に帯電したバリウム イオンと負に帯電した硝酸イオンが静電力によって結合されて構成されています。 Ba(NO3)2 の構造は、結晶格子内のイオンの配置を示す最小の繰り返し単位である単位格子で表すことができます。
Ba(NO3)2 の単位格子は立方体の形状をしており、各隅にバリウム イオンがあり、各面の中心に硝酸イオンがあります。各イオンの配位数は 6 です。これは、各イオンが 6 つの反対の電荷をもつイオンに囲まれていることを意味します。単位セルの各辺の長さは 0.65 nm です。
硝酸バリウムの溶解度
Ba(NO3)2 溶解度は、所定量の溶媒 (通常は水) に溶解できる Ba(NO3)2 の量です。溶解度は、温度、圧力、溶液中の他の物質の存在など、いくつかの要因に依存します。
20℃、大気圧では、Ba(NO3)2 の水への溶解度は 100 ml あたり約 34 g です。これは、これらの条件下で 34 g の Ba(NO3)2 が 100 ml の水に溶解できることを意味します。溶解度は温度が上昇すると増加し、圧力が増加すると減少します。
Ba(NO3)2 は、エタノール、アセトン、メタノールなどの他の溶媒にも可溶ですが、水よりも溶解度が低くなります。
| 外観 | 白色固体 |
| 比重 | 3.23 |
| 色 | 無色、シルバーまたはグレー |
| 匂い | 無臭 |
| モル質量 | 261,337 g/モル |
| 密度 | 3.23g/ml |
| 融合点 | 592℃ |
| 沸点 | 83℃ |
| フラッシュドット | 不燃性 |
| 水への溶解度 | 20℃で100mlあたり34g |
| 溶解性 | エタノール、アセトン、メタノールに可溶。エーテルおよびクロロホルムに不溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 利用不可 |
硝酸バリウムの安全性と危険性
Ba(NO3)2 は有毒で酸化性の物質です。飲み込んだり吸い込んだりすると害を及ぼす可能性があります。これは目、皮膚、呼吸器系を刺激する可能性があります。 Ba(NO3)2 は、筋肉のけいれん、心臓の問題、死亡を引き起こす可能性もあります。 Ba(NO3)2 との接触を避け、取り扱うときは保護具を着用する必要があります。また、熱、火花、炎、可燃物から遠ざけてください。 Ba(NO3)2 にさらされた場合は、目と皮膚を水で洗い流し、医師の診察を受けてください。バリウムの毒性を軽減するために硫酸塩を摂取することもできます。
| ハザードシンボル | O(酸化剤)、Xn(有害) |
| セキュリティの説明 | S13: 動物用を含む飲食物から遠ざけてください。 S17: 可燃物から遠ざけてください。 S22:粉塵を吸い込まないでください。 S26: 目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。 S36/37/39: 適切な保護服、手袋、目/顔の保護具を着用してください。 |
| 国連識別番号 | UN1446 |
| HSコード | 2834 29 10 |
| 危険等級 | 5.1 (酸化性物質) |
| 梱包グループ | Ⅲ |
| 毒性 | LD50 (経口、ラット) = 355 mg/kg; LC50 (吸入、ラット) = 0.15 mg/L/4h |
硝酸バリウムの合成方法
さまざまな方法を使用して、白色の固体物質である Ba(NO3)2 を作成できます。
1 つの方法には、炭酸バリウムと硝酸を反応させることが含まれます。これにより、Ba(NO3)2 と二酸化炭素が生成されます。 Ba(NO3)2 溶液を濾過して鉄不純物を除去し、蒸発させて固体結晶を取得します。
別の方法は、硫化バリウムと硝酸を反応させることです。これにより、Ba(NO3)2 と硫化水素が生成されます。 Ba(NO3)2 溶液を精製して結晶化するには、以前と同じプロセスに従います。
3 番目の方法では、金属バリウムまたは酸化バリウムを硝酸に溶解します。これにより、Ba(NO3)2 と水素または水が生成されます。次いで、Ba(NO 3 ) 2 を含む溶液を濃縮し、結晶化させる。
4 番目の方法は、溶融塩合成を使用することです。これには、Ba(NO3)2 と塩化アンモニウム、重炭酸ナトリウム、亜硝酸ナトリウムなどの無機発泡剤の混合物を加熱することが含まれます。発泡剤は分解され、Ba(NO3)2 結晶内に細孔が形成されます。これにより、火工品酸化剤としての信頼性が高まります。
Ba(NO3)2 を合成する方法のいくつかを以下に示します。これらはすべて共通の反応物質として硝酸を使用し、生成物として Ba(NO3)2 を生成します。
硝酸バリウムの用途
Ba(NO3)2 の用途には次のようなものがあります。
- 酸化バリウム化合物 – セラミック、ガラス、ブラウン管など、酸化バリウムを含む材料の製造に使用されます。
- 緑色の炎 – バリウムイオンの放出により緑色の炎をあげて燃えるため、緑色の信号機や花火に使用されます。
- 殺鼠剤 – ラットやマウスにとって有毒であるため、それらを殺すための殺鼠剤として使用されます。
- 酸化剤 – 雷管や爆発物に使用され、他の物質の燃焼を促進する強力な酸化剤です。
- プライマー – 点火と弾薬の可視性を提供するため、プライマーと曳光弾に使用されます。
- 顔料 – 白や緑色を与えることができるため、塗料や顔料の製造に使用されます。
- 酸化剤 – 過酸化バリウムや水酸化バリウムの合成など、さまざまな化学反応で酸化剤として使用されます。
- 爆薬 – Ba(NO3)2、TNT、結合剤の混合物である Baratol などの爆薬の製造に使用されます。
質問:
Q: 硝酸バリウムは水溶性ですか?
A: Ba(NO3)2 は水と、エタノール、アセトン、メタノールなどの他の溶媒に可溶です。
Q: 硝酸バリウムはコンクリートに使用できますか?
A: Ba(NO3)2 は鉄筋の腐食やコンクリートの亀裂を引き起こす可能性があるため、コンクリートには使用できません。
Q: 硫酸カリウムと硝酸バリウムの溶液を混ぜると沈殿が生成しますか?
A: はい、硫酸カリウム (K2SO4) と硝酸バリウム (Ba(NO3)2) の溶液を混合すると、硫酸バリウム (BaSO4) の沈殿が形成されます。
Q: 硝酸バリウムの化学式は Ba(NO3)2 です。硝酸バリウムについて正しいのはどれですか?
A: 考えられるステートメントの 1 つは次のとおりです。Ba(NO3)2 は 1 つのバリウム イオンと 2 つの硝酸イオンから構成されるイオン化合物です。
Q: 硝酸バリウムは揮発性ですか?
A: いいえ、Ba(NO3)2 は融点が高く、沸騰する前に分解するため、揮発性ではありません。
Q: 硝酸バリウムは中性ですか?
A: いいえ、Ba(NO3)2 は溶液の pH を下げる可能性のある酸性塩であるため、中性ではありません。
Q: Ba(NO3)2 と Na2SO4 の置換反応では何が生成されますか?
A: Ba(NO3)2 と Na2SO4 の置換反応中に NaNO3 と BaSO4 が生成されます。
Q: Ba(NO3)2 は水に溶けますか?
A: はい、Ba(NO3)2 は水に溶けます。溶解してバリウム イオンと硝酸イオンを形成します。
Q: MgSO4 と Ba(NO3)2 の反応の正味のイオン方程式は何ですか?
A: MgSO4 と Ba(NO3)2 の反応の正味のイオン方程式は次のとおりです。
Ba2+ + SO42- → BaSO4
Q: 432 g の Ba(NO3)2 は何モルですか?
A: 432 g の Ba(NO3)2 のモル数は次のとおりです。
n = m/M、n = 432/261,337、n = 1,653 モル
Q: Ba(NO3)2 は可溶ですか?
A: はい、Ba(NO3)2 は溶解してバリウム イオンと硝酸イオンを形成するため、可溶性です。
