硝酸アンモニウム (NH4NO3) は化合物です。肥料や爆薬として使用できます。水によく溶け、吸湿性にも優れています。
| IUPACの名称 | 硝酸アンモニウム |
| 分子式 | NH4NO3 |
| CAS番号 | 6484-52-2 |
| 同義語 | 硝酸アンモニウム塩、硝酸アンモニウム(AN)、硝酸アンモニウム、ニトラム、ニトラモン |
| インチチ | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
硝酸アンモニウムの性質
硝酸アンモニウムの処方
硝酸アンモニウムは、式 NH4NO3 の化合物です。これは、アンモニウム (NH4+) と硝酸塩 (NO3-) の 2 つのイオンで構成されており、これらはイオン結合によって結合されています2 。白色の結晶性粉末で水に溶けやすい。
硝酸アンモニウムのモル質量
NH4NO3 のモル質量は 80.043 g/mol です。それは、その構成要素である窒素、水素、酸素のモル質量を追加することによって計算できます。窒素のモル質量は 14.0067 g/mol、水素のモル質量は 1.00784 g/mol、酸素のモル質量は 15.9999 g/mol です。
NH4NO3 のモル質量 = 2 x 窒素のモル質量 + 4 x 水素のモル質量 + 3 x 酸素のモル質量
NH4NO3 のモル質量 = 28.0134 g/mol + 4.03136 g/mol + 47.9997 g/mol
NH4NO3 のモル質量 = 80.043 g/mol
硝酸アンモニウムの沸点
NH4NO3 には定義された沸点がありません。高温で分解し、窒素、酸素、水蒸気などのガスを放出します。 NH4NO3 の分解温度は、純度、湿度、不純物や添加物の存在によって異なります。純粋な NH4NO3 の分解温度は約 210°C または 483 K です。
硝酸アンモニウムの融点
NH4NO3 の融点は 169.6 °C または 442.8 K です。この温度で菱面体晶構造から立方晶構造に相転移します。また、水と共晶混合物を形成することもあり、その融点は約 -16 °C または 257 K と低くなります。
硝酸アンモニウムの密度 g/ml
NH4NO3 の密度は、周囲温度および常圧で 1.725 g/ml または 1725 kg/m3 です。これは、同じ条件下で約 1 g/ml または 1000 kg/m3 の密度を持つ水よりも密度が高くなります。 NH4NO3 の密度は、温度が上昇すると熱膨張により減少します。
硝酸アンモニウムの分子量
NH4NO3 の分子量はそのモル質量と同じで、80.043 g/mol です。分子量は、NH4NO3 の 1 モルまたは 6.022 x 10^(23) 分子の質量です。分子量は、炭素 12 原子の質量の 12 分の 1 として定義される原子質量単位 (amu) で表すこともできます。
NH4NO3 の分子量 (amu) は 80.043 x (1/12) x (10^(23)) amu です。
NH4NO3 の分子量 (amu) は約 6.669 x 10^(23) amu です。
硝酸アンモニウムの構造
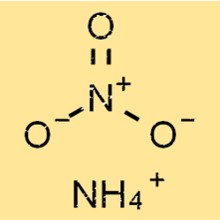
NH4NO3 は、正に帯電したアンモニウム イオンと負に帯電した硝酸イオンから構成される単純なイオン構造を持っています。アンモニウム イオンは四面体の形状をしており、4 つの水素原子が共有結合によって中心の窒素原子に結合しています。
NH4+
H
|
HNH
|
H
硝酸イオンは三角形の平面形状をしており、3 つの酸素原子が共有結合によって中央の窒素原子に結合しており、そのうちの 1 つは二重結合です。
No.3-
おお
||
おお
硝酸アンモニウムの溶解度
NH4NO3 の溶解度は、水または他の溶媒に溶解するこの化合物の量を指します。 NH4NO3 は水に非常に溶けやすく、その溶解度は温度とともに増加します。たとえば、20℃では 150 g の NH4NO3 が 100 ml の水に溶解しますが、100℃では 1024 g が同量の水に溶解します。 NH4NO3 はメタノール、エタノール、アセトンにも溶解しますが、ジエチルエーテルやクロロホルムには溶解しません。 NH4NO3 の溶解度は、酸、塩基、塩、有機化合物などの他の物質の存在に依存します。これらの物質の中には、NH4NO3 の安定性に影響を与え、分解や爆発を引き起こす可能性のあるものがあります。
| 外観 | 白色の結晶固体 |
| 比重 | 1,725 |
| 色 | 白またはグレー |
| 匂い | 無臭 |
| モル質量 | 80.043 g/モル |
| 密度 | 1.725 g/ml または 1725 kg/m3 |
| 融合点 | 169.6℃または442.8K |
| 沸点 | 約。 210°C または 483 K (分解) |
| フラッシュドット | 不燃性 |
| 水への溶解度 | 吸熱性、118g/100ml (0℃)、150g/100ml (20℃)、297g/100ml (40℃)、410g/100ml (60℃)、576g/100ml (80℃)、1024g/100ml (100℃) |
| 溶解性 | 水、メタノール、エタノール、アセトンに可溶。ジエチルエーテル、クロロホルムに不溶 |
| 蒸気圧 | 室温では無視できる |
| 蒸気密度 | 該当なし(実線) |
| pKa | 9.25 (NH4+の場合) |
| pH | 5.0~6.0(10%水溶液) |
硝酸アンモニウムの安全性と危険性
NH4NO3 の安全性と危険性は、この化合物を扱ったり保管したりする人にとって重要です。 NH4NO3 は酸化剤であり、可燃性物質と混合したり、熱、衝撃、汚染にさらされたりすると、火災が激化し、爆発を引き起こす可能性があります。 NH4NO3 は分解時に窒素酸化物やアンモニアなどの有毒ガスを放出する可能性もあります。したがって、NH4NO3 を取り扱うときは、次の安全上の注意事項に従う必要があります。
- 火源、有機物質、酸、金属、その他の混入しない物質から離れた、涼しく乾燥した換気の良い場所に保管してください。
- 取り扱うときは、保護服、手袋、目と顔を保護するものを着用してください。
- 移動時には粉塵の発生を避け、十分な換気を行ってください。
- 取り扱い後は手と顔をよく洗ってください。
- 摂取したり吸入したりしないでください。万が一暴露した場合は医師にご相談ください。
- 地元の緊急対応者に施設内に NH4NO3 が存在することを知らせ、緊急対応計画を作成します。
| ハザードシンボル | O(酸化剤)、Xi(刺激剤) |
| セキュリティの説明 | S17 (可燃物から遠ざける)、S26 (目に入った場合は、すぐに多量の水で洗い流し、医師の診断を受けてください)、S36/37/39 (適切な保護服、手袋、目/顔の保護具を着用してください)、S42 (燻蒸/噴霧中は、適切な呼吸器を着用してください) |
| 国連識別番号 | S17 (可燃物から遠ざける)、S26 (目に入った場合は、すぐに多量の水で洗い流し、医師の診断を受けてください)、S36/37/39 (適切な保護服、手袋、目/顔の保護具を着用してください)、S42 (燻蒸/噴霧中は、適切な呼吸器を着用してください) |
| HSコード | 3102.30 (硝酸アンモニウム、水溶液かどうかを問わない) |
| 危険等級 | 5.1 (酸化剤) |
| 梱包グループ | Ⅲ(危険性が低い) |
| 毒性 | LD50 (経口、ラット) = 2,085-5,300 mg/kg |
硝酸アンモニウムの合成法
肥料や爆発物として広く使用されているこの化合物を製造するために、化学者は NH4NO3 を合成するさまざまな方法を使用します。 NH4NO3 を合成するにはさまざまな方法がありますが、最も一般的なのは次のとおりです。
- ハーバー・ボッシュおよびオストワルド法: この方法では、窒素と水素のガスを反応させてアンモニアを生成し、次にアンモニアを空気で酸化して硝酸を生成します。 NH4NO3 を形成するには、アンモニアと硝酸を中和します。この方法は高温、高圧、エネルギーを必要とし、大量の二酸化炭素を排出します。
- メタセシス反応: この方法には、可溶性アンモニウム塩と可溶性硝酸塩を反応させて、NH4NO3 と別の塩を形成することが含まれます。たとえば、硫酸アンモニウムと硝酸バリウムは反応して、NH4NO3 と硫酸バリウムを形成します。この方法は簡単で、高温や高圧を必要としませんが、副生成物が生成されるため、分離または廃棄する必要がある場合があります。
- プラズマプロセス: この方法は、低温低圧のプラズマを使用して空気中の窒素を土壌に固定し、土壌中に直接 NH4NO3 を形成します。この方法は水素ガスや触媒を必要とせず、二酸化炭素も排出しません。また、土壌を窒素で豊かにし、植物の成長を促進することもできます。
硝酸アンモニウムの用途
NH4NO3 の用途は次のとおりです。
- 肥料: NH4NO3 は植物にとって一般的な窒素源であり、約 33.5% の窒素が含まれており、そのすべてが植物によって吸収されます。メーカーは、固まったり湿気を吸収したりするのを防ぐために、白または灰色の炭酸アンモニウムペレットを粘土でコーティングします。水に簡単に溶けるため、固体でも溶液でも適用できます。
- 爆薬: NH4NO3 は、ニトログリセリン、TNT、RDX、アルミニウム粉末などの他の爆薬の爆発を促進する酸化剤です。北米で使用される爆発物の 80% を占める広く使用されている工業用爆発物は、主成分として ANFO (NH4NO3 と燃料油) を含んでいます。即席爆発装置で使用する場合は爆発させるために強力な起爆剤が必要ですが、産業用途でも使用できます。
- 花火: 花火では NH4NO3 を使用して、煙、火花、星、稲妻などのさまざまな効果を作り出すことができます。水と混合すると吸熱反応を起こすため、冷湿布にも使用できます。
- その他の用途: 亜酸化窒素 (笑気) の前駆体、麻酔薬、噴射剤として使用されます。窒素酸化物は吸収剤として使用でき、酵母と抗生物質は栄養素として使用でき、冷凍混合物は成分として使用できます。
質問:
Q: 硝酸アンモニウム肥料はどこから来ますか?
A: NH4NO3 肥料は、アンモニアと硝酸の反応から生じる合成生成物です。アンモニアは天然ガスなどから得られ、硝酸はアンモニアを空気で酸化することで生成されます。 NH4NO3 肥料は、空気中の窒素を土壌に固定するプラズマプロセスを使用して生成することもできます。
Q: 硝酸アンモニウムとは何ですか?
A: NH4NO3 は、式 NH4NO3 の化合物です。アンモニウムイオンと硝酸イオンから構成される白色の結晶性の塩です。水溶性が高く、固体では吸湿性がありますが、水和物は形成しません。
Q: 硝酸アンモニウムは何に使用されますか?
A: NH4NO3 は主に肥料と爆発物の 2 つの目的に使用されます。肥料として、植物に成長と代謝に不可欠な窒素を供給します。爆発物としては、ANFO (NH4NO3 および燃料油) などの他の爆発物の爆発を促進する酸化剤として作用します1 。また、亜酸化窒素 (笑気ガス)、冷湿布、花火、酵母の栄養剤の製造など、他の目的にも使用できます。
Q: 硝酸アンモニウムの分子式は何ですか?
A: 硝酸アンモニウムの分子式は NH4NO3 です。分子量は 80,043 g/mol で、質量比で 35% の窒素を含みます。
Q: 硝酸アンモニウム肥料は何からできていますか?
A: NH4NO3 肥料は NH4NO3 と、場合によっては粘土、固結防止剤、安定剤などの他の添加剤で構成されています。商用グレードには約 33.5% の窒素が含まれており、すべて植物が摂取できる形になっています。
Q: 硝酸アンモニウムは酸ですか、それとも塩基ですか?
A: NH4NO3 は酸でも塩基でもなく、塩です。水中でアンモニウムイオンと硝酸イオンに解離し、溶液の pH に応じて弱酸または弱塩基として作用します。アンモニウム イオンの pKa は 9.25 です。これは、アンモニウム イオンがプロトンを供与し、塩基性溶液中で酸として作用することができることを意味します。硝酸イオンには pKa がありません。つまり、プロトンを供与したり受け取ったりすることはできませんが、塩基として作用し、酸性溶液中でヒドロニウムイオンと硝酸を形成します。
Q: 硝酸アンモニウムの爆発?
A: NH4NO3 爆発は、NH4NO3 が急速に分解し、窒素、酸素、水蒸気などの大量のガスを放出するときに発生する激しい化学反応です。分解は、熱、衝撃、摩擦、汚染、閉じ込めによって引き起こされる可能性があります。 NH4NO3 の爆発は、建物、人、環境に重大な損害を引き起こす可能性があります。 NH4NO3 爆発の例としては、1947 年のテキサスシティ災害、1921 年のオッパウ爆発、2015 年の天津爆発、2020 年のベイルート爆発などがあります。
Q: 硝酸アンモニウムを購入するにはどうすればよいですか?
A: NH4NO3 の購入には、お住まいの国または地域によってはライセンスまたは許可が必要な場合があります。実際、NH4NO3 は、公共の安全を脅かす可能性のある爆発物や即席爆発装置の製造に使用される可能性があります。 NH4NO3 を購入する際には、身元、住所、連絡先の詳細、製品の使用目的の提供が求められる場合もあります。 NH4NO3 は、地域の規制や基準に準拠する承認された供給業者または販売業者から購入できます。また、NH4NO3 の事故や誤用を避けるために、適切な保管と取り扱いのガイドラインに従う必要があります。
