塩素酸ナトリウムは、式 NaClO3 の化合物です。これは、マッチ、染料、除草剤の製造に一般的に使用される強力な酸化剤です。
| IUPAC名 | 塩素酸ナトリウム |
| 分子式 | NaClO3 |
| CAS番号 | 7775-09-9 |
| 同義語 | 塩素酸、ナトリウム塩;ナクロ3;塩素酸、ナトリウム塩 (1:1); UN1495;塩素酸ナトリウム;塩化ナトリウム; |
| インチチ | InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
塩素酸ナトリウムの性質
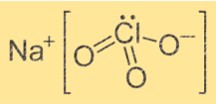
塩素酸ナトリウムの式
塩素酸ナトリウムの化学式は NaClO3 です。これは、1 つの Na+ イオンと 1 つの ClO3- イオンから構成されるイオン性化合物です。 Na+ イオンは正電荷を持ち、一方 ClO3- イオンは負電荷を持ちます。この式は、Na+ イオンが ClO3- イオンと結合して化合物を形成することを示しています。
塩素酸ナトリウムのモル質量
NaClO3 のモル質量は 106.44 g/mol です。これは、アボガドロの分子数 (6.022 x 10^23) を含む化合物 1 モルの質量です。化合物内のすべての原子の原子質量を加算することによって計算されます。
塩素酸ナトリウムの沸点
NaClO3 の沸点は 300°C (572°F) です。これは、化合物が液体から気体に変化する温度です。沸点は、分子間の分子間力の強さによって決まります。
塩素酸ナトリウムの融点
NaClO3 の融点は 248°C (478°F) です。これは、化合物が固体状態から液体状態に変化する温度です。融点は、分子間の分子間力の強さによって決まります。
塩素酸ナトリウムの密度 g/mL
NaClO3 の密度は 2.49 g/mL です。単位体積あたりの化合物の質量です。密度は物質の質量と体積によって決まります。
塩素酸ナトリウムの分子量
NaClO3 の分子量は 106.44 g/mol です。これは、化合物内のすべての原子の原子量の合計です。
塩素酸ナトリウムの構造
NaClO3 の構造は結晶です。 Na+ イオンは、6 つの異なる ClO3- イオンからの 6 つの酸素原子に囲まれています。 ClO3- イオンは Na+ イオンの周囲に四面体形状を形成します。この構造は、Na+ イオンと ClO3- イオン間のイオン結合によって結合されています。
塩素酸ナトリウムの溶解度
NaClO3 は水、エタノール、メタノールに可溶です。水に容易に溶解し、無色透明の溶液を形成します。 NaClO3 の水への溶解度は温度とともに増加します。 20℃での溶解度は85 g/100 mLの水です。
| 外観 | 白色固体 |
| 比重 | 2.49 g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 106.44 g/モル |
| 密度 | 2.49g/ml |
| 融合点 | 248°C (478°F) |
| 沸点 | 300°C (572°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 85g/100ml |
| 溶解性 | 水、エタノール、メタノールに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | ニュートラル (7) |
塩素酸ナトリウムの安全性と危険性
NaClO3 は強力な酸化剤であるため、取り扱いには注意が必要です。紙、木、油などの有機物と接触すると、火災や爆発の潜在的な危険性があります。また、還元剤、酸、金属粉末と激しく反応する可能性があります。 NaClO3 を摂取または吸入すると、呼吸障害、腹痛、嘔吐などの重大な健康影響を引き起こす可能性があります。 NaClO3 は、皮膚、目、呼吸器系を刺激する可能性もあります。 NaClO3 を扱うときは、暴露や潜在的な危険を避けるために、手袋、ゴーグル、マスクなどの適切な保護具を着用する必要があります。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 飲み込むと有害、重度の眼刺激を引き起こし、気道への炎症を引き起こす可能性があります |
| 国連識別番号 | 国連 1495 |
| HSコード | 2829.19.00 |
| 危険等級 | 5.1 (酸化性物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 飲み込んだり吸入すると有毒で、皮膚や目を刺激します。 |
塩素酸ナトリウムの合成方法
NaClO3 を合成するにはいくつかの方法が存在します。
一般的な方法は、塩化ナトリウム溶液を電気分解することです。これには、溶液に電流を流すことが含まれ、これにより塩化ナトリウムが NaClO3 と塩素ガスに分解されます。別の方法では、水酸化ナトリウムを塩素ガスと反応させて、NaClO3 と塩化ナトリウムを生成します。
3 番目の方法では、触媒の存在下で炭酸ナトリウムと塩素ガスを反応させます。これにより、NaClO3、塩化ナトリウム、二酸化炭素が生成されます。次亜塩素酸ナトリウムと水酸化ナトリウムの反応により、代替として NaClO3 が生成されます。この反応により、NaClO3、塩化ナトリウム、水が生成します。
これらの方法に加えて、NaClO3 は亜塩素酸ナトリウムと過酸化水素の反応によっても生成できます。この反応により、NaClO3、水、酸素ガスが生成されます。
塩素酸ナトリウムの用途
NaClO3 はさまざまな産業でさまざまな用途に使用されます。一般的な用途には次のようなものがあります。
- 除草剤: 除草剤として広く使用されており、特に道端、鉄道線路、送電線などの未耕作地域の雑草を抑制するために使用されます。植物の光合成を阻害することで、さまざまな雑草を効果的に防除します。
- 漂白剤: 紙パルプ産業で漂白剤として使用されます。特に高品質の光沢のある白色紙を製造する場合に効果的です。
- 鉱業: 金やその他の貴金属を抽出するための酸化剤として鉱業で使用されます。
- 爆発物: ダイナマイトや塩素酸アンモニウムなどの爆発物の製造の原料として使用されます。
- 染料と顔料: 染料と顔料の製造、特に繊維製品の着色に使用されます。
- 研究室:実験室でさまざまな化学反応の試薬として使用されます。
- 水処理: 藻類の増殖を抑制するため、および消毒剤として水処理に使用されます。
- 食品保存料: 特定の食品の保存期間を延長するための食品保存料としても使用されます。
質問:
Q: 塩素酸ナトリウムはどうやって作るのですか?
A: NaClO3 は、塩化ナトリウム溶液の電気分解、水酸化ナトリウムと塩素ガスの反応、触媒存在下での炭酸ナトリウムと塩素ガスの反応などのいくつかの方法で製造できます。
Q: 塩素酸ナトリウムが雑草を殺すのにどれくらい時間がかかりますか?
A: NaClO3 は強力な除草剤であり、散布後数日以内に雑草を枯らすことができます。雑草を枯らすのに必要な時間は、使用する NaClO3 の濃度や対象となる雑草の種類などの要因によって異なります。
Q: 塩素酸ナトリウムは純粋な物質ですか?
A: はい、NaClO3 はナトリウム、塩素、酸素原子のみで構成される化合物であるため、純粋な物質です。
Q: 塩素酸ナトリウムは水に溶けますか?
A: はい、NaClO3 は水によく溶けます。水に溶けて無色透明の溶液を形成します。
Q: 塩素酸ナトリウムの分子には酸素原子が何個ありますか?
A: NaClO3 分子には 3 つの酸素原子があります。その化学式はNaClO3です。
Q: 塩素酸ナトリウムはイオン性ですか、それとも共有結合性ですか?
A: NaClO3 はイオン性化合物です。これは、ナトリウム原子から塩素原子への電子の移動によって形成され、正に帯電した Na+ イオンと負に帯電した NaClO3 イオンが形成されます。
