亜硫酸カリウム (K2SO3) は、カリウム、硫黄、酸素から構成される化合物です。食品業界では、変色や腐敗を防ぐ防腐剤として一般的に使用されています。
| IUPAC名 | 亜硫酸カリウム |
| 分子式 | K2SO3 |
| CAS番号 | 10117-38-1 |
| 同義語 | 亜硫酸二カリウム;亜硫酸二カリウム塩。スルホン酸カリウム;硫黄と酸化カリウム |
| インチチ | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
亜硫酸カリウム
亜硫酸カリウムの処方
亜硫酸カリウムの化学式は K2SO3 で、カリウム原子 2 つ、硫黄原子 1 つ、酸素原子 3 つが含まれていることを示します。この化合物は、水酸化カリウム (KOH) と二酸化硫黄 (SO2) の反応によって形成されます。亜硫酸カリウムはイオン性化合物であり、正に帯電したカリウムイオンと負に帯電した亜硫酸イオンで構成されています。亜硫酸イオンの式はSO32-です。
亜硫酸カリウムのモル質量
K2SO3 のモル質量は 158.26 g/mol です。これは、式 (2 x K の原子量) + S の原子量 + (3 x O の原子量) の各元素の原子量を加算することによって計算されます。化合物のモル質量は、特定の反応に必要な化合物の量を計算したり、溶液の濃度を決定したりするのに役立つため重要です。
亜硫酸カリウムの沸点
K2SO3 は沸点に達する前に分解するため、特定の沸点がありません。ただし、K2SO3 は加熱すると熱分解して硫酸カリウム (K2SO4) と二酸化硫黄 (SO2) を生成します。分解温度は約390℃です。
亜硫酸カリウムの融点
K2SO3の融点は約350℃です。この温度では、固体化合物は液体に変わります。ただし、前述したように、温度が上昇すると K2SO3 は分解します。
亜硫酸カリウムの密度 g/mL
K2SO3 の密度は室温で 2.44 g/mL です。密度は、単位体積あたりの物質の質量として定義されます。 K2SO3 の密度が高いことは、K2SO3 が比較的重い化合物であることを示しています。この特性は、溶解性や反応性などの化合物の物理的特性を決定する際に重要です。
亜硫酸カリウムの分子量
K2SO3 の分子量は 158.26 g/mol です。この値は、化合物の分子の平均質量を表します。分子量は、特定の体積または質量内の物質の量を計算するために重要であり、化学反応や実験室での実験に役立ちます。
亜硫酸カリウムの構造
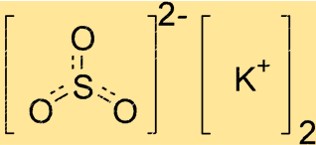
K2SO3 は結晶構造を持っています。これは、その原子が繰り返しパターンで配置されていることを意味します。この化合物は、中心に硫黄原子、その周囲に 3 つの酸素原子が対称的に配置された、三角形の平面形状を持っています。カリウムイオンはこの構造の外側に位置し、亜硫酸イオンの負電荷のバランスをとります。
亜硫酸カリウムの溶解度
K2SO3 は水によく溶けます。室温では水に溶解して無色透明の溶液を形成することがあります。 K2SO3 の溶解度は、水中で構成イオンに解離できるイオン性によるものです。 K2SO3 の溶解度は温度にも影響され、温度が上昇すると溶解度は増加します。
| 外観 | 白色の結晶性粉末 |
| 比重 | 2.44 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 158.26 g/モル |
| 密度 | 2.44g/ml |
| 融合点 | 350℃ |
| 沸点 | 390℃で分解 |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水に非常に溶けやすい |
| 溶解性 | エタノールおよびグリセロールに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 10.3(亜硫酸の場合) |
| pH | ~9 (0.1 M 溶液の場合) |
亜硫酸カリウムの安全性と危険性
K2SO3 は、適切な予防措置を講じていれば、比較的安全に取り扱い、使用できます。ただし、慎重に扱わないと危険が生じる可能性があります。この化合物が皮膚、目、呼吸器系のこれらの部分に接触すると、炎症を引き起こす可能性があります。 K2SO3 を摂取すると、胃腸障害を引き起こす可能性もあります。さらに、この化合物は熱や炎にさらされると火災や爆発の危険を引き起こす可能性があります。したがって、K2SO3 を扱う場合は、保護具を着用し、化合物を熱や発火源から遠ざけて保管するなど、適切な安全対策を講じる必要があります。
| ハザードシンボル | どくろ |
| セキュリティの説明 | 有毒、飲み込むと有害、皮膚や目を刺激する |
| 国連識別番号 | 国連 2697 |
| HSコード | 283210 |
| 危険等級 | 6.1 (有毒物質) |
| 梱包グループ | II(中危険) |
| 毒性 | 経口 (LD50): 345 mg/kg (ラット) |
亜硫酸カリウムの合成法
K2SO3 は、水酸化カリウムと二酸化硫黄または硫黄の反応、炭酸カリウムと二酸化硫黄の反応、亜硫酸水素カリウムと水酸化物との反応など、さまざまな方法で合成できます。カリウム。
最初の方法では、水酸化カリウムの溶液が水の存在下で二酸化硫黄ガスと反応して K2SO3 を形成します。 2 番目の方法では、炭酸カリウムと二酸化硫黄の混合物を高温に加熱して K2SO3 を生成します。 3 番目の方法では、亜硫酸水素カリウムと水酸化カリウムを混合して K2SO3 と水を生成します。
K2SO3 を合成する別の一般的な方法は、ハイドロ亜硫酸ナトリウムや硫酸鉄(II)などの還元剤の存在下で、二酸化硫黄と塩化カリウムなどのカリウム塩とを反応させることです。この方法は、大量の K2SO3 を生成するために工業環境でよく使用されます。
亜硫酸カリウムの用途
K2SO3 は、その化学的特性により、さまざまな産業でいくつかの用途があります。 K2SO3 の一般的な用途をいくつか示します。
- 食品および飲料産業: ワイン、ドライフルーツ、エビなどの食品の腐敗や変色を防ぐための食品保存料として使用されます。
- 写真: フィルムのさらなる現像を防ぎ、画像を永久的なものにする写真定着剤として使用されます。
- 水処理: 水から塩素を除去し、廃水を処理するための還元剤として使用されます。
- 製紙産業: 製紙プロセスで不純物を除去し、パルプを白くするための漂白剤として使用されます。
- 繊維産業: 生地から余分な染料を除去し、生地を白くするための還元剤として使用されます。
- 化学工業: 酸化剤を還元剤に変換する化学反応における還元剤として使用されます。
- 医薬品産業: 特定の状態の症状を予防または軽減するために、一部の医療処置で使用されます。
質問:
Q: 亜硫酸カリウムの式は何ですか?
A: 亜硫酸カリウムの化学式は K2SO3 です。
Q: 硫酸カリウムは亜硫酸塩ですか?
A: いいえ、硫酸カリウムは亜硫酸塩ではありません。これは、カリウム、硫黄、酸素から構成される化学式 K2SO4 の塩です。
Q: H2SO4 が NaOH と反応すると、どのような塩が生成されますか? K2SO3、Na2SO4、Na2SO3、K2SO4
A: H2SO4 が NaOH と反応すると、生成される塩は Na2SO4 です。
Q: 99.6 mg の Na2SO3 には SO32 イオンが何個含まれていますか?
Na2SO3 のモル質量は 126.05 g/mol です。 A: SO32- イオンの数を計算するには、まず Na2SO3 のモル数を見つける必要があります: 99.6 mg / 126.05 g/mol = 0.000789 mol。 Na2SO3 には 1 分子あたり 2 つの SO32- イオンが含まれるため、0.000789 mol の Na2SO3 中の SO32- イオンの数は、0.000789 mol x 2 = 0.00158 mol となります。したがって、99.6 mg の Na2SO3 には、0.00158 mol x 6.022 x 10^23 イオン/mol = 9.52 x 10^20 SO32- イオンが存在します。
Q: 99.6 mg の Na2SO3 にはナトリウムイオンがいくつ含まれていますか? Na2SO3 のモル質量は 126.05 g/mol です。
A: ナトリウム イオンの数を計算するには、まず Na2SO3 のモル数を見つける必要があります: 99.6 mg / 126.05 g/mol = 0.000789 mol。 Na2SO3 の各分子には 2 つのナトリウムイオンが含まれるため、0.000789 モルの Na2SO3 中のナトリウムイオンの数は、0.000789 mol x 2 = 0.00158 mol となります。したがって、99.6 mg の Na2SO3 には、0.00158 mol x 6.022 x 10^23 イオン/mol = 9.52 x 10^20 のナトリウムイオンが存在します。
Q: Na2SO3 の化学名は何ですか?
A: Na2SO3 の化学名は亜硫酸ナトリウムです。
Q: 式 Na2SO3 の化合物の名前は何ですか?
A: 式 Na2SO3 の化合物の名前は亜硫酸ナトリウムです。
