チオ硫酸ナトリウムは、式 Na2S2O3 の化合物です。写真処理の定着剤として、また特定の化学反応における還元剤として一般的に使用されます。
| IUPAC名 | チオ硫酸ナトリウム |
| 分子式 | Na2S2O3 |
| CAS番号 | 7772-98-7 |
| 同義語 | 次亜硫酸ナトリウム、チオ硫酸ナトリウム、チオ硫酸二ナトリウム塩、チオ硫酸ナトリウム五水和物 |
| インチチ | InChI=1S/2Na・H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
チオ硫酸ナトリウムの性質
チオ硫酸ナトリウムの処方
チオ硫酸ナトリウムの化学式は Na2S2O3 です。 2 つの Na+ イオンと 2 つの S2O3 2- イオンから構成されます。式は、化合物の分子内に存在する原子の種類と数を示します。
チオ硫酸ナトリウムのモル質量
Na2S2O3 のモル質量は 158.11 g/mol です。化合物 1 モル中に存在するすべての原子の原子質量を加算することによって計算されます。この値は、特定の反応に必要な Na2S2O3 の量を決定したり、溶液の濃度を計算したりするのに役立ちます。
チオ硫酸ナトリウムの沸点
Na2S2O3 は沸点に達する前に分解するため、沸点を持ちません。常圧では 48 ~ 55°C で分解し、二酸化硫黄を放出します。この特性により、高温用途には不向きになります。
チオ硫酸ナトリウム 融点
Na2S2O3 の融点は 48.3°C です。これは、固体化合物が液体に状態を変化させる温度です。他の無機塩に比べて融点が比較的低く、水に溶けやすい性質があります。
チオ硫酸ナトリウムの密度 g/mL
Na2S2O3 の密度は 1.667 g/mL です。この値は、単位体積あたりの物質の質量を指します。これは水の密度よりも大きいため、Na2S2O3 は水に沈みます。
チオ硫酸ナトリウムの分子量
Na2S2O3 の分子量は 158.11 g/mol です。化合物の分子内に存在するすべての原子の原子量の合計です。分子量は、特定の反応に必要な Na2S2O3 の量を決定したり、溶液の濃度を計算したりするのに役立ちます。
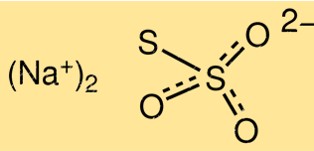
チオ硫酸ナトリウムの構造
Na2S2O3 の構造は、ナトリウム イオン Na+ に結合した 2 つの S2O3 2- イオンから構成されます。分子は三角錐の形をしており、結合角は約103度です。チオ硫酸イオンは、1 つの硫黄-硫黄結合と 2 つの硫黄-酸素結合を持っています。
チオ硫酸ナトリウムの溶解度
Na2S2O3 は水に非常に溶けます。 Na2S2O3 の水への溶解度は温度とともに増加し、25℃では約 70 g の化合物が 100 ml の水に溶解します。グリセロールにも溶け、アルコールにもわずかに溶けます。その溶解性を利用して、写真処理や医療などさまざまな用途に役立ちます。
| 外観 | 白色の結晶性粉末 |
| 比重 | 1,667g/mL |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 158.11 g/モル |
| 密度 | 1,667g/mL |
| 融合点 | 48.3℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | グリセロールに可溶、アルコールにわずかに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 中性(pH7) |
チオ硫酸ナトリウムの安全性と危険性
Na2S2O3 は一般に、正しく取り扱われれば安全であると考えられています。ただし、摂取したり、吸入したり、目や皮膚に接触した場合は有害となる可能性があります。この化合物は皮膚や目に炎症を引き起こす可能性があり、長時間暴露すると皮膚炎を引き起こす可能性があります。 Na2S2O3 を摂取すると、吐き気や嘔吐などの胃腸の不快感を引き起こす可能性があります。 Na2S2O3 を扱う場合は、手袋や安全メガネなどの適切な個人用保護具を着用することが重要です。暴露した場合は、患部を水で洗い流し、必要に応じて医師の診察を受けてください。
| ハザードシンボル | なし |
| セキュリティの説明 | 目、皮膚、衣類との接触を避けてください。摂取しないでください。適切な個人用保護具を着用してください。 |
| 国連識別番号 | UN3077 |
| HSコード | 2832.3010.00 |
| 危険等級 | 9 |
| 梱包グループ | Ⅲ |
| 毒性 | 毒性が低い。 LD50 (経口、ラット) は 6,200 mg/kg |
チオ硫酸ナトリウムの合成方法
Na2S2O3 はさまざまな方法で合成できます。
一般的な方法は、アルカリ溶液の存在下で亜硫酸ナトリウムと硫黄を反応させることです。別の方法では、亜硫酸ナトリウムを加圧下で二酸化硫黄と反応させる必要があります。
Na2S2O3 を調製する 1 つの方法は、亜硫酸ナトリウムと水酸化ナトリウムの熱溶液に硫黄を溶解することです。溶液が冷却され、誰かがそれを濾過して固体生成物を得る。
この方法では、二酸化硫黄を水酸化ナトリウムと反応させて亜硫酸ナトリウムを生成し、次に元素硫黄と反応させて Na2S2O3 を生成します。
Na2S2O3 を生成するには、硫酸を亜硫酸ナトリウムと反応させ、得られた溶液を加熱して硫黄を添加します。亜硫酸ナトリウムは硫黄と反応して Na2S2O3 を形成します。
別の方法では、水酸化ナトリウムを硫黄と反応させ、続いて亜硫酸ナトリウムを添加して Na2S2O3 を形成します。
チオ硫酸ナトリウムの用途
Na2S2O3 は、次のようなさまざまな産業や用途で幅広い用途に使用されます。
- 写真: 写真プリントやフィルムから未露光のハロゲン化銀を除去するための定着剤として使用されます。
- 水処理: 塩素を中和し、水生生物への悪影響を防ぐことにより水を脱塩素するために使用されます。
- 医療用途: シアン化物と反応してチオシアン酸塩を形成するため、シアン化物中毒の治療に使用されます。チオシアン酸塩は毒性が低く、体外に排出されます。
- 産業用途: 化学プロセスにおける還元剤として、また繊維、皮革、紙の防腐剤として使用されます。
- 分析化学: 銅やヒ素などのさまざまな金属の分析で滴定剤として使用されます。
- 食品および飲料業界: 変色を防ぐための食品保存料および風味増強剤として使用されます。
- 園芸: 植物の灌漑に使用される水中の塩素の影響を中和するために使用されます。
質問:
Q: チオ硫酸ナトリウムは何に使用されますか?
A: Na2S2O3 には、写真、水処理、医療、工業プロセス、分析化学、食品および飲料の保存、園芸など、幅広い用途があります。
Q: チオ硫酸ナトリウムはどうやって作るのですか?
A: Na2S2O3 は、アルカリ溶液の存在下で亜硫酸ナトリウムと硫黄または二酸化硫黄を反応させることによって合成できます。他の方法では、水酸化ナトリウムを硫黄または二酸化硫黄と反応させて亜硫酸ナトリウムを生成し、その後硫黄と反応して Na2S2O3 を生成します。
Q: チオ硫酸金ナトリウムとは何ですか?
A: 金 Na2S2O3 は、塩化金と Na2S2O3 の反応によって形成される複合化合物です。金めっきや分析化学で金の検出と定量に使用されます。
Q: チオ硫酸ナトリウムはどこで購入できますか?
A: Na2S2O3 は、化学薬品の供給業者、実験用品の供給会社、オンライン小売業者から購入できます。
Q: チオ硫酸ナトリウムはどこで入手できますか?
A: Na2S2O3 は、写真用化学薬品、水処理製品、医療処置など、さまざまな製品に含まれています。
Q: Na2S2O3 の硫黄の酸化数は何ですか?
A: Na2S2O3 の硫黄の酸化数は、チオ硫酸イオン (S2O3^2-) では +2、硫酸イオン (SO4^2-) では +6 です。
Q: Na2S2O3 の滴定から Cu の重量を求めるにはどうすればよいですか?
A: Cu の重量は、Cu と Na2S2O3 間の反応の平衡化学方程式を使用して、滴定に使用される Na2S2O3 溶液の体積とモル濃度から計算できます。
Q: 化学量論量の Na2S2O3 が添加されたことはどのようにしてわかりますか?
A: 反応の終点に達した時点で化学量論量の Na2S2O3 が添加されており、これは色やその他の物理的または化学的特性の変化によって示されます。
Q: 0.15 M KI 5 滴を Na2S2O3 40 滴に添加した場合、KI の最終濃度はどれくらいですか?
A: KI の最終濃度は、Na2S2O3 溶液の量や濃度などの追加情報がなければ決定できません。
Q: Na2S2O3 のモル濃度はどのようにして求めますか?
A: Na2S2O3 のモル濃度は、モル濃度 = 溶質のモル / 溶液の体積 (リットル) という式を使用して、サンプルの質量と、それを溶解するために使用した溶液の体積および濃度から計算できます。
