臭素 (Br2) は、2 つの臭素原子で構成される二原子分子です。室温では赤褐色の液体であり、非常に反応性が高い。製薬、農業、水処理などさまざまな産業で使用されています。
| IUPAC名 | 臭素 |
| 分子式 | Br2 |
| CAS番号 | 7726-95-6 |
| 同義語 | 臭素、分子状臭素、UN 1744、二原子臭素、臭素-79、臭素-81 |
| インチチ | InChI=1S/Br2/c1-2 |
臭素の性質
臭素の式
臭素の化学式は Br2 です。これは、臭素分子には 2 つの臭素原子が含まれていることを意味します。式は物質の組成を表すために使用され、化学反応では不可欠です。臭素配合物は、製薬、水処理、農業などのさまざまな産業で使用されています。
臭素モル質量
Br2 のモル質量は 159.808 g/mol です。これは、Br2 分子 1 モルの質量です。モル質量は、特定の反応に必要な物質の量を決定するのに役立つため、化学において不可欠な特性です。物質のグラムとモルを変換するためにも使用されます。
臭素の沸点
Br2 の沸点は 58.8°C (137.8°F) です。これは、Br2 が液体から気体に変化する温度です。 Br2 の沸点が低いのは、分子間力が弱いためであり、分子間力により分子が液体状態からより容易に脱出することができます。 Br2 は反応性が高いため、高温で取り扱うと危険な物質になります。
臭素の融点
Br2 の融点は -7.2°C (19.0°F) です。これは、固体の Br2 が液体の状態に変化する温度です。 Br2 の融点が低いのは、分子間力が弱いためであり、そのため分子は固体状態でより容易に移動できます。 Br2 は、ハロゲンの中では珍しく、室温で液体で存在するというユニークな性質を持っています。
臭素濃度 g/mL
Br2 の密度は 3.12 g/mL です。これは、1 ミリリットルの Br2 の質量が 3.12 グラムであることを意味します。 Br2 の高密度は、その分子量と液体状態での分子の緻密さによるものです。 Br2 は密度が高いため、重有機合成反応に役立ちます。
臭素分子量
Br2 の分子量は 79.90 g/mol です。これは、Br2 分子内の 2 つの Br 原子の原子量の合計です。分子量は、特定の反応に必要な物質の量を決定するのに役立つため、化学において不可欠な特性です。
臭素の構造
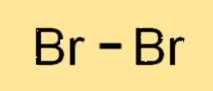
Br2 は二原子分子であり、2 つの Br 原子が結合してできていることを意味します。 2 つの Br2 原子は一対の電子を共有し、共有結合を形成します。 Br2 分子は 2 つの Br 原子が直線上に並んだ直線構造をしています。 Br2 の構造は、塩素やヨウ素などの他のハロゲンと似ています。
| 外観 | 赤褐色の液体 |
| 比重 | 3.12g/ml |
| 色 | 赤茶色 |
| 匂い | 刺激性の刺激臭 |
| モル質量 | 159,808 g/モル |
| 密度 | 3.12g/ml |
| 融合点 | -7.2°C (19.0°F) |
| 沸点 | 58.8°C (137.8°F) |
| フラッシュドット | 不燃性 |
| 水への溶解度 | 3.41g/100ml (25℃) |
| 溶解性 | クロロホルム、四塩化炭素、エーテルに可溶 |
| 蒸気圧 | 1.13 kPa(25℃) |
| 蒸気密度 | 5.4g/L |
| pKa | -5 |
| pH | 適用できない |
臭素の安全性と危険性
Br2 は有害な化学物質であるため、慎重に取り扱う必要があります。これは腐食性の液体であり、皮膚や目に重大な刺激を引き起こす可能性があります。 Br2 蒸気を吸入すると呼吸器疾患を引き起こす可能性があり、高レベルにさらされると致命的になる可能性があります。 Br2 は強力な酸化剤でもあり、可燃性物質と激しく反応して火災や爆発を引き起こす可能性があります。 Br2 を扱うときは、手袋、ゴーグル、マスクなどの適切な保護具を常に着用する必要があります。冷たく乾燥した換気の良い場所に、熱源や混触しない物質から離して保管する必要があります。流出または事故が発生した場合は、直ちにその場から避難し、適切な清掃手順に従ってください。
| ハザードシンボル | どくろ、腐食性 |
| セキュリティの説明 | 非常に有毒で、腐食性があり、皮膚、目、呼吸器系を刺激します。 |
| 国連識別番号 | UN1744 |
| HSコード | 2801.30 |
| 危険等級 | 8 |
| 梱包グループ | Ⅱ |
| 毒性 | LD50 (経口、ラット) = 2 ~ 3 mg/kg |
臭素の合成法
所望の純度と量に応じて、さまざまな方法を使用して Br2 を合成できます。
1 つの方法では、鉄などの触媒の存在下で塩水を塩素ガスで処理します。次に、得られた次亜塩素酸ナトリウムと塩化ナトリウムの溶液を塩酸で酸性化し、Br2 ガスを放出します。
別の方法には、白金やアスベストなどの触媒の存在下で臭化水素ガスを酸素ガスで酸化する方法があります。業界では一般に、アプリケーション向けに高純度の Br2 を製造するためにこの方法が使用されています。
電気分解では、溶液に電流を流すことで塩水から Br2 が抽出され、ナトリウムイオンと塩化物イオンが分離され、副産物として Br2 ガスが生成されます。
臭素の用途
Br2 には、さまざまな業界で次のような重要な用途があります。
- メーカーは、炎の延焼を防ぎ火災のリスクを軽減するために、繊維、プラスチック、電子機器の難燃剤として Br ベースの化合物を使用しています。
- 製薬会社は、さまざまな鎮静剤、精神安定剤、鎮痛剤の製造に Br ベースの化合物を組み込んでいます。
- 水処理プラントでは、細菌、ウイルス、その他の有害な微生物を効果的に殺すための消毒剤として Br ベースの化合物が使用されています。
- 殺虫剤や除草剤の製造業者は、害虫や雑草を効果的に防除するために臭素系化合物を使用しています。
- 石油・ガス産業では、腐食を抑制し、石油回収率を向上させるために、掘削作業に Br ベースの化合物を使用しています。
- メーカーは、画像の感度とコントラストを効果的に制御するために、写真フィルムや写真用紙の製造に Br ベースの化合物を使用します。
- 化学合成反応では、染料、プラスチック、医薬品を製造するための反応物質として Br2 が使用されます。
質問:
Q: Br2 は極性ですか、それとも無極性ですか?
A: Br2 は、両方の臭素原子が同じ電気陰性度を持ち、共有結合における電子の均等な共有をもたらすため、非極性分子です。
Q: 極性共有結合を含む可能性が最も高い化合物はどれですか? NaCl、AlF3、Br2、NF3?
A: 極性共有結合を含む可能性が最も高い化合物は NF3 (三フッ化窒素) です。これは、窒素原子とフッ素原子の電気陰性度が大きく異なるため、共有結合における電子の共有が不均等になるためです。
Q: この反応の ΔH0 は何ですか? Br2 (g) → Br2 (l)、ΔHf° Br2 (g) = 30.91 kJ/mol
A: Br2 の蒸発熱は 41.48 kJ/mol、融解熱は 30.91 kJ/mol (質問に記載) であるため、反応の ΔH0 は -10.57 kJ/mol です。
Q: Br2 は気体ですか?
A: Br2 は、温度と圧力の条件に応じて、気体状態と液体状態で存在します。室温および標準圧力では、Br2 は赤茶色の液体です。
Q: 臭素は何に使われますか?
A: 臭素は、難燃剤、水処理、医薬品、殺虫剤、石油・ガス産業、写真、化学合成など、さまざまな産業でいくつかの重要な用途があります。
Q: 臭素は金属ですか?
A: いいえ、臭素は金属ではありません。周期表のハロゲン族に属する非金属元素です。
