硫酸カルシウム (CaSO4) は、天然または工業的に生成される白色の粉末です。結合剤、充填剤、栄養素としての特性により、建築、食品、医薬品に使用されています。
| IUPAC名 | 硫酸カルシウム |
| 分子式 | CaSO4 |
| CAS番号 | 7778-18-9 |
| 同義語 | 石膏、無水石膏、硬石膏、二水和物、カルシウム塩、亜セレン酸塩 |
| インチチ | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
硫酸カルシウムの性質
硫酸カルシウムの配合
硫酸カルシウムの化学式は CaSO4 です。これは、各硫酸カルシウム分子には 1 つのカルシウム原子、1 つの硫黄原子、および 4 つの酸素原子が含まれていることを意味します。この式は、化学方程式で硫酸カルシウムの組成を表し、化学反応に必要な反応物の量を計算するために使用されます。
硫酸カルシウムのモル質量
CaSO4 のモル質量は約 136.14 g/mol です。この値は、化合物内の 1 つのカルシウム原子、1 つの硫黄原子、および 4 つの酸素原子の原子量を追加することによって計算されます。モル質量は、化学反応に必要な CaSO4 の量を決定し、溶液中の CaSO4 の濃度を計算するために使用されます。
硫酸カルシウムの沸点
CaSO4 は沸点に達する前に熱分解を受けるため、定義された沸点がありません。ただし、分解することなく 200°C を超える温度まで加熱できます。高温では、CaSO4 は吸熱分解を受けて、酸化カルシウムと三酸化硫黄を形成します。
硫酸カルシウムの融点
CaSO4 の融点は、その水和状態に依存します。 CaSO4 の無水形態の融点は約 1460 ℃ですが、二水和形態の融点は約 128 ℃ と低くなります。半水和物と三水和物の形態は中間の融点を持ちます。
硫酸カルシウムの密度 g/mL
CaSO4 の密度は、その形状と水和状態によって異なります。 CaSO4 の無水形態の密度は約 2.96 g/mL ですが、二水和形態の密度は約 2.32 g/mL です。半水和物と三水和物の密度は中間です。
硫酸カルシウムの分子量
CaSO4 の分子量は約 136.14 g/mol です。この値は、化合物内の 1 つのカルシウム原子、1 つの硫黄原子、および 4 つの酸素原子の原子量を追加することによって計算されます。分子量は、化学反応に必要な CaSO4 の量を計算し、溶液中の CaSO4 の濃度を決定するために使用されます。
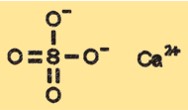
硫酸カルシウムの構造
CaSO4 の結晶構造は、その水和状態に応じて変化します。 CaSO4 の無水物は斜方晶系に分類される結晶構造を持ち、二水和物は単斜晶系の結晶構造を持ちます。半水和物と三水和物は、無水物と二水和物の中間の異なる結晶構造を持っています。
| 外観 | 白色または固体の粉末 |
| 比重 | 2.96 (無水)、2.32 (二水和物) |
| 色 | 白または無色 |
| 匂い | 無臭 |
| モル質量 | 136.14 g/モル |
| 密度 | 2.96 g/cm3 (無水)、2.32 g/cm3 (二水和物) |
| 融合点 | 1460℃(無水)、128℃(二水和物) |
| 沸点 | 沸点が定義されていない |
| フラッシュドット | 適用できない |
| 水への溶解度 | 0.24g/100ml(20℃) |
| 溶解性 | 水とグリセリンに可溶、エタノールに不溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 9.8 (最初の解離)、11.8 (2 番目の解離) |
| pH | 7 (ニュートラル) |
硫酸カルシウムの安全性と危険性
CaSO4 は一般に使用および取り扱いが安全であると考えられていますが、適切に扱わないと健康上のリスクを引き起こす可能性があります。 CaSO4 粉塵を吸入すると呼吸器系に炎症を引き起こす可能性があり、大量の化合物を摂取すると胃腸障害を引き起こす可能性があります。 CaSO4 が目や皮膚に接触すると、炎症や乾燥を引き起こす可能性があります。 CaSO4 は特定の化学物質と反応して危険な副生成物を生成する可能性もあります。したがって、CaSO4 を取り扱うときは適切な個人用保護具を着用し、不適合物質から離れた涼しく乾燥した換気の良い場所に保管する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | 飲み込むと有害。皮膚や目の炎症を引き起こします。 |
| 国連識別番号 | 規制されていません |
| HSコード | 2833.29.00 |
| 危険等級 | 規制 (EC) No 1272/2008 [CLP] に従って危険物質または混合物として分類されていません |
| 梱包グループ | 適用できない |
| 毒性 | LD50 (経口、ラット): > 2000 mg/kg |
硫酸カルシウムの合成法
化合物の目的の形態と水和状態に応じて、いくつかの方法で CaSO4 を合成できます。
一般的な方法は、炭酸カルシウムまたは酸化カルシウムを硫酸と反応させることです。この反応により、CaSO4 と二酸化炭素または水がそれぞれ生成されます。
別の方法では、塩化カルシウムと硫酸ナトリウムを反応させ、CaSO4 を沈殿させます。 CaSO4二水和物の天然鉱物形態である石膏の熱脱水により、CaSO4が生成されます。
発電所の排煙脱硫などの一部の工業プロセスでは、副産物として CaSO4 が生成されます。このプロセス中に、二酸化硫黄は炭酸カルシウムと反応して亜硫酸カルシウムを形成し、これが酸化されて CaSO4 が生成されます。
CaSO4 に使用される合成方法は、粒子サイズ、結晶化度、純度などの特性に影響を与える可能性があります。したがって、化合物の意図された用途に適した方法を選択することが重要です。
硫酸カルシウムの用途
CaSO4 は、低毒性、高融点、白色などの独特の特性により、さまざまな産業で多くの用途に使用されています。 CaSO4 の一般的な用途には次のようなものがあります。
- 構造: セメントおよび石膏ボードの主要な構成要素であり、バインダーおよびパテとして機能します。
- 食品と飲料: 豆腐の製造における凝固剤として、また一部のチーズや野菜の缶詰の固化剤として使用されます。
- 医薬品: 錠剤やカプセルの製造において充填剤および結合剤として使用されます。
- 農業: 土壌構造を改善し、作物の収量を増加させるための土壌改良剤として使用されます。
- 化学薬品: 顔料、紙、繊維加工などのさまざまな化学薬品の製造に使用されます。
- 化粧品:増量剤および不透明剤として化粧品配合物に使用されます。
- 水処理:不純物を除去し、スケールを低減するために水処理に使用されます。
- プラスチックおよびゴム: プラスチックおよびゴム製品の充填剤および補強剤として使用されます。
質問:
Q: 硫酸カルシウムはビーガンですか?
A: はい、CaSO4 は動物由来ではないため、ビーガンとみなされます。
Q: 病院における硫酸カルシウムの主な用途は何ですか?
A: CaSO4 は、骨折のギプスとして病院で一般的に使用されていました。
Q: 硫酸カルシウムとリンの質量は何ですか?
A: この質問は不完全であり、具体的な回答を得るにはさらに詳しい情報が必要です。
Q: CaSO4 は水に溶けますか?
A: CaSO4 は水への溶解度が低く、室温での溶解度は約 2.05 g/L です。
Q: CaSO4 は可溶ですか?
A: 硫酸カルシウムは水への溶解度が低く、室温での溶解度は約 2.05 g/L です。
Q: CaSO4 のモル質量はどれくらいですか?
A: CaSO4 のモル質量は約 136.14 g/mol です。
Q: pH が 7 未満の塩はどれですか? KBr、HCOOK、CaSO4、NH4NO3
A: リストされている塩はどれも、純粋な形で pH < 7 を持ちません。ただし、NH4NO3 (硝酸アンモニウム) は水に溶解すると、pH < 7 の酸性溶液を生成します。
