水酸化マグネシウム (Mg(OH)2) は、胸やけ、消化不良、便秘の治療に使用される制酸剤および下剤です。胃酸を中和し、水を結腸に引き込んで排便を促進する働きがあります。
| IUPAC名 | 水酸化マグネシウム |
| 分子式 | Mg(OH)2 |
| CAS番号 | 1309-42-8 |
| 同義語 | マグネシアミルク;ブルーサイト;二水酸化マグネシウム;ハイドロマグネサイト。ホワイトマグネシア |
| インチチ | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
水酸化マグネシウムの性質
水酸化マグネシウムの配合
水酸化マグネシウムの化学式は Mg(OH)2 です。この式は、マグネシウム原子が 2 つの水酸化物イオンに結合していることを示しています。水酸化マグネシウムの式は、物質のモル質量、密度、その他の物理的特性を計算するために使用されます。この式は、水酸化マグネシウム分子内に存在する原子の数と種類を示すため、物質の構造についての洞察も得られます。
水酸化マグネシウムのモル質量
Mg(OH)2 のモル質量は 58.32 g/mol です。これは、1 モルの Mg 原子と 2 モルの OH- イオンを含む、1 モルの Mg(OH)2 の質量です。モル質量は、特定のサンプル中の物質の量を計算するために使用されるため、化学において重要な概念です。
水酸化マグネシウムの沸点
Mg(OH)2 は沸点に達する前に分解するため、明確な沸点を持ちません。 Mg(OH)2 の分解温度は約 350°C です。加熱すると、Mg(OH)2 が分解して酸化マグネシウムと水が生成します。
水酸化マグネシウムの融点
Mg(OH)2の融点は350℃です。この温度では、固体の Mg(OH)2 が液体状態に変化します。このプロセスはマージとして知られています。融点は、固体が液体に変化する温度を決定するため、物質の重要な物理的特性です。
水酸化マグネシウムの密度 g/mL
Mg(OH)2 の密度は約 2.36 g/mL です。密度は、単位体積あたりの物質の質量として定義されます。 Mg(OH)2 は、分子量が高く、Mg 原子あたり 2 つの OH- イオンが存在するため、比較的高密度の物質です。
水酸化マグネシウムの分子量
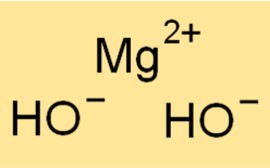
Mg(OH)2 の分子量は 58.32 g/mol です。これは、Mg(OH)2 分子内のすべての原子の原子量の合計です。分子量は、特定のサンプル中の物質の量を決定するために使用されるため、化学では有用な概念です。
水酸化マグネシウムの構造
Mg(OH)2 は Mg2+ イオンと OH- イオンからなる層状構造をしています。 Mg2+ イオンは 6 つの OH- イオンに囲まれており、OH- イオンは最密六方晶構造で配置されています。 Mg(OH)2 の層状構造により、水への溶解度が低く、水中で懸濁液を形成する能力などの特徴的な特性が生じます。
| 外観 | 白色の粉末または懸濁液 |
| 比重 | 2.36g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 58.32 g/モル |
| 密度 | 2.36g/ml |
| 融合点 | 350℃ |
| 沸点 | 350℃で分解 |
| フラッシュドット | 適用できない |
| 水への溶解度 | 20℃で12mg/L |
| 溶解性 | エタノール、エーテルに不溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 10.4 |
| pH | 10.5 |
水酸化マグネシウムの安全性と危険性
Mg(OH)2 は一般に、毒性が低く、発がん性の影響は知られていないため、安全に取り扱い、使用できると考えられています。ただし、Mg(OH)2 の粉塵や粉末に長時間さらされると、呼吸器への刺激や肺の損傷を引き起こす可能性があります。 Mg(OH)2 が接触すると、目、皮膚、粘膜に炎症や腐食を引き起こす可能性があります。 Mg(OH)2 を取り扱うときは、保護具を着用し、換気の良い場所で作業するなど、適切な安全上の注意事項に従うことが重要です。接触または暴露した場合は、医師の診察を受け、患部を水でよく洗い流してください。
| ハザードシンボル | なし |
| セキュリティの説明 | – 吸入したり、目、皮膚、衣類と接触したりしないようにしてください。 – 保護服、手袋、目/顔の保護具を着用してください。 – 換気の良い場所で使用してください。 |
| 国連識別番号 | 規制されていません |
| HSコード | 2826.90.90 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 毒性が低い。長時間暴露すると、呼吸器への刺激や肺の損傷を引き起こす可能性があります。 |
水酸化マグネシウムの合成法
Mg(OH)2 は、沈殿法、水熱合成法、電気化学析出法など、さまざまな方法で合成できます。
沈殿法では、水酸化ナトリウムまたは水酸化アンモニウムを塩化マグネシウムまたは硫酸マグネシウムと反応させて、Mg(OH)2 を形成します。この反応により Mg(OH)2 が生成され、誰かがそれを集めて乾燥させることができます。
水熱合成を行うには、酸化マグネシウムまたは炭酸マグネシウムを加えながら、水を高圧かつ高温に加熱する必要があります。このプロセスでは Mg(OH)2 が生成され、得られた溶液を冷却することで結晶を収集できます。
電気化学堆積では、マグネシウムイオンの溶液に電流を流し、マグネシウムイオンを水酸化物イオンと反応させ、陰極上に Mg(OH)2 を形成します。
Mg(OH)2 を合成する他の方法には、酸化マグネシウムと石灰乳の使用、および重炭酸マグネシウムの熱分解が含まれます。
各方法には、有効性、効率、コストの点で長所と短所があります。合成方法の選択は、特定の用途と Mg(OH)2 製品の望ましい特性によって異なります。
水酸化マグネシウムの用途
Mg(OH)2 は、次のようなさまざまな業界で幅広い用途があります。
- 制酸剤: 胃酸を中和し、胸やけ、消化不良、その他の消化器系の不快感を軽減するための制酸剤として一般的に使用されます。
- 難燃剤: 火災の危険を軽減するためにプラスチック、ゴム、繊維に使用される非毒性の難燃剤。
- pH調整:水処理液、化粧品、医薬品など各種製品のpH調整に使用されます。
- 環境修復: 酸性条件を中和し、重金属を除去するために、廃水および酸性鉱山排水の処理に使用されます。
- 肥料:植物にマグネシウムを提供し、土壌のpHを改善するために肥料として使用されます。
- 医療用途: 下剤として、また結腸内視鏡検査などの一部の医療処置で腸を洗浄するために使用されます。
- その他の用途: ラテックス塗料の安定剤、紙の増白剤、ガラスやセラミックの研磨剤として使用されます。
質問:
Q: 歯磨き粉に使用される基剤とは何ですか?
A: Mg(OH)2 は、口内の酸性状態を中和し、虫歯のリスクを軽減するために、歯磨き粉の基剤として一般的に使用されています。
Q: 水酸化マグネシウムの式は何ですか?
A: 水酸化マグネシウムの化学式は Mg(OH)2 です。
Q: 水酸化マグネシウムの解離を示す化学式は何ですか?
A: Mg(OH)2 の解離の化学式は次のとおりです。
Mg(OH)2 → Mg2+ + 2OH-。
Q: 水酸化マグネシウムは水に溶けますか?
A: Mg(OH)2 は水に溶けにくいため、非常に限られた範囲でしか溶解しません。
Q: 次の物質のうち、アレニウス酸はどれですか? BF3、HCN、NH3、Mg(OH)2?
A: リストされている物質はいずれもアレニウス酸ではありません。 BF3 と HCN はルイス酸、NH3 は弱いアレニウス塩基、Mg(OH)2 は強いアレニウス塩基です。
Q: Mg(OH)2 は水に溶けますか?
A: Mg(OH)2 は水に溶けにくいため、非常に限られた範囲でしか溶解しません。
Q: Mg(OH)2 のモル質量はどれくらいですか?
A: Mg(OH)2 のモル質量は約 58.32 g/mol です。
Q: Mg(OH)2 は酸ですか、それとも塩基ですか?
A: Mg(OH)2 は水素イオン (プロトン) を受け取って水と塩を形成することができるため、塩基です。
