リン酸 (H3PO4) は無色無臭の鉱酸です。食品・飲料業界では香料として、また自動車業界では防錆剤として広く使用されています。
| IUPAC名 | リン酸 |
| 分子式 | H3PO4 |
| CAS番号 | 7664-38-2 |
| 同義語 | オルトリン酸、トリヒドロキシドオキシドリン、リン酸(V)、オルトリン酸、クリアリン酸テクノロジー、リン酸塩 |
| インチチ | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
リン酸の性質
リン酸のモル質量
リン酸のモル質量は 98.00 g/mol です。この値は、分子の各構成原子 (1 つのリン原子と 3 つの酸素原子) の原子量を加算することによって計算されます。モル質量は、アボガドロ数を使用して特定のサンプル中に存在する物質の量を計算するために使用されるため、化合物の重要な特性です。さらに、リン酸のモル質量は、滴定によって溶液の濃度を決定するために使用されます。
リン酸の配合
リン酸の化学式は H3PO4 で、リン原子 1 つ、水素原子 3 つ、酸素原子 4 つが含まれていることを示します。これは、最大 3 つの水素イオンを塩基に供与できる弱酸です。この式は、化学方程式を記述したり、リン酸が関与する化学反応の化学量論を計算したりできるため、重要です。さらに、この公式は、滴定によってリン酸溶液の濃度を計算するために使用されます。
リン酸の沸点
リン酸の沸点は 1 気圧で 158°C (316°F) です。これは、この温度と圧力では、リン酸の液相が気相に変化することを意味します。沸点は化合物に存在する分子間力に依存し、リン酸の場合、沸点は分子間の水素結合の存在によるものです。沸点は化合物の揮発性を決定するために使用されるため、化合物の重要な物理的特性であり、多くの工業プロセスで役立ちます。
リン酸の融点
リン酸の融点は 42.35°C (108.23°F) です。これは、リン酸の固相が液相に変化する温度です。融点は化合物に存在する分子間力の強さに依存し、リン酸の場合、融点は分子間の水素結合の存在によるものです。融点は、化合物の純度を決定し、その同一性を確立するために使用されるため、化合物の重要な物理的特性です。
リン酸の密度 g/ml
リン酸の密度は、室温 (25°C または 77°F) で 1.685 g/ml です。これは単位体積あたりの物質の質量です。密度は物質の物理的特性であり、物質の特定の質量の体積、または物質の特定の体積の質量を計算するために使用されます。リン酸の濃度は、肥料、洗剤、食品添加物の製造を含む多くの工業プロセスにおいて重要です。
リン酸の分子量
リン酸の分子量は 98.00 g/mol です。これは、分子内のすべての原子の原子量の合計です。分子量は、特定のサンプル中に存在する物質の量を計算するために使用されるため、化合物の重要な特性です。さらに、リン酸の分子量は、滴定によって溶液の濃度を決定するために使用されます。
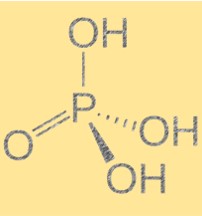
リン酸(H3PO4)の構造
リン酸の分子式は H3PO4 で、分子構造は四面体です。これは三プロトン酸であり、1 つの塩基に 3 つの水素イオンを供与できることを意味します。この分子には 4 つの酸素原子に結合したリン原子が含まれており、そのうちの 3 つは水素原子に結合しています。リン酸の構造は、その化学的および物理的特性を決定するため重要です。分子間に水素結合が存在すると、沸点と融点が高くなります。
| 外観 | 無色の液体 |
| 比重 | 25℃で1.685 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 98.00g/モル |
| 密度 | 1.685 g/ml(25℃) |
| 融合点 | 42.35°C (108.23°F) |
| 沸点 | 1気圧で158°C (316°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水に完全に溶ける |
| 溶解性 | エタノール、ジエチルエーテル、アセトンに可溶 |
| 蒸気圧 | 0.0002 mmHg(20℃) |
| 蒸気密度 | 3.5 (空気 = 1) |
| pKa | pKa1=2.148、pKa2=7.198、pKa3=12.319 |
| pH | 1.0~2.5(濃縮液)、2.8~3.2(希釈液) |
H3PO4 の安全性と危険性
リン酸にはいくつかの安全上のリスクがあるため、慎重に取り扱う必要があります。重度の皮膚や目に炎症を引き起こす可能性があり、金属に対して非常に腐食性があります。皮膚、目、粘膜に直接接触すると、重度の火傷や永久的な損傷を引き起こす可能性があります。フュームを吸入すると、気道の炎症や火傷を引き起こす可能性があります。重度の内部火傷や胃腸障害を引き起こす可能性があるため、摂取しないでください。リン酸を取り扱うときは、手袋、ゴーグル、呼吸用保護具などの適切な個人用保護具を着用する必要があります。また、酸化剤やアルカリなどの不適合物質から離れた涼しく乾燥した場所に保管する必要があります。
| ハザードシンボル | 腐食性 |
| セキュリティの説明 | 容器をしっかり閉めて保管してください。保護手袋/保護服/保護眼鏡/保護面を着用してください。 |
| 国連識別番号 | UN1805 |
| HSコード | 280920 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | II(中危険) |
| 毒性 | 経口LD50 (ラット) – 1533 mg/kg |
H3PO4の合成法
リン酸 (H3PO4) を合成するにはいくつかの方法が存在します。
最も一般的な方法は、リン酸岩と硫酸の反応を伴う湿式プロセスです。硫酸カルシウム(石膏)と H3PO4 を製造するには、まずリン酸塩岩を粉砕し、次に濃硫酸と混合します。得られた懸濁液を濾過した後、一連の溶媒抽出および沈殿ステップにより H3PO4 が精製されます。
H3PO4 を合成するもう 1 つの方法は、リン酸塩岩を高温に加熱して H3PO4 および元素リンや酸化カルシウムなどの他の副産物を生成する熱プロセスです。この方法は高いエネルギーを必要とするため、湿式プロセスほど一般的ではありません。
五酸化リンと水の反応により H3PO4 が合成されます。エレクトロニクスおよび半導体産業では、高純度の H3PO4 を生成するためにこの方法が一般的に使用されています。
H3PO4 を合成する他の方法には、リンの電気化学的酸化、三塩化リンの加水分解、およびリンと硝酸の反応が含まれます。これらの方法はコストが高く複雑であるため、湿式プロセスや熱プロセスほど一般的ではありません。
H3PO4の用途
リン酸は、さまざまな産業で幅広い用途を持つ多用途化合物です。その主な用途は次のとおりです。
- 肥料製造:リン酸二アンモニウムや三過リン酸塩などの肥料製造の主成分。
- 食品および飲料産業: コーラ飲料、ジャム、プロセスチーズなどのさまざまな食品および飲料製品に食品添加物および香料として使用されます。
- 工業用洗浄: 錆やその他の鉱物堆積物を溶解する能力があるため、工業分野で洗浄剤および錆除去剤として使用されます。
- 水処理: 工業プロセスで水の pH レベルを制御し、重金属やその他の不純物を除去するために使用されます。
- 医薬品: pH レベルを調節する能力があるため、医薬品や栄養補助食品の製造に使用されます。
- 歯科: 根管治療などの歯科処置や歯科用セメントの成分として使用されます。
- 金属処理: ステンレス鋼、アルミニウム、チタンなどの金属を処理および不動態化し、耐食性を向上させるために使用されます。
- エレクトロニクス: エレクトロニクス産業で洗浄剤として、また半導体製造のコンポーネントとして使用されます。
質問:
Q: リン酸の式は何ですか?
A: リン酸の式は H3PO4 です。
Q: H3PO4 は強酸ですか?
A: いいえ、H3PO4 は強酸とみなされません。 pKa値が2.15の弱酸です。
Q: H3PO4 は酸ですか、それとも塩基ですか?
A: H3PO4 は、水に溶解するとプロトン (H+) を供与するため、酸です。
Q: H3PO4 のルイス構造は何ですか?
A: H3PO4 のルイス構造は、中心のリン原子が 4 つの酸素原子に囲まれた四面体構造です。各酸素原子はリン原子と単結合を形成し、各酸素原子には孤立電子も 3 対存在します。
Q: リン酸は強酸ですか? A: いいえ、リン酸は強酸とは見なされません。これは、最初のプロトン供与の pKa 値が 2.15、2 回目のプロトン供与の pKa 値が 7.20 の弱酸です。
