塩化カリウム(KCl)は、カリウムと塩素を含む化合物です。肥料、食品添加物、低カリウム値の治療薬として使用されます。致死注射にも使用される可能性があります。
| IUPAC名 | 塩化カリウム |
| 分子式 | KCl |
| CAS番号 | 7447-40-7 |
| 同義語 | KCl、クロラタムカリウム、カリ酸塩、シルバイト、クロロカスリル、カリタブ、クロトリックス、Klor-Con、K-Dur |
| インチチ | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
塩化カリウムの処方
塩化カリウムの化学式はKClです。これは、1 つのカリウム原子と 1 つの塩素原子で構成される二元化合物です。塩化カリウムの式は、その化学的特性を理解し、さまざまな用途での使用に関連する計算を実行するために重要です。
塩化カリウムのモル質量
KCl のモル質量は 74.55 g/mol です。白色の結晶性固体で塩味があり、水によく溶けます。 KCl は、1 つのカリウム原子と 1 つの塩素原子から構成される化合物です。
塩化カリウムの沸点
KCl の沸点は 1,420 °C (2,588 °F) です。これは高融点化合物であり、沸点に達するまでに多量のエネルギーを必要とします。 KCl は沸点が高いため、セラミックやガラスの製造などの高温用途に役立ちます。
KClの融点
KCl の融点は 770°C (1,418°F) です。これは比較的高い融点の化合物であり、溶解するにはかなりの熱を必要とします。 KCl は肥料の製造に使用され、融点が高いため、高温での安定性が確保されます。
KCl 濃度 g/ml
KCl の密度は 1.98 g/cm3 です。これは比較的高密度の化合物であり、少量に多数の粒子が含まれていることを意味します。 KCl は高密度であるため、掘削液の製造など、特定の産業用途に役立ちます。
KClの分子量
KCl の分子量は 74.55 g/mol です。これは比較的軽い化合物であり、含まれる粒子の数が少ないことを意味します。 KCl は分子量が低いため、産業環境での輸送や取り扱いが容易になります。
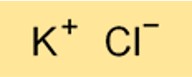
KCl構造
KCl の構造はイオン結晶格子です。それは、繰り返しパターンで配置された交互のカリウムイオンと塩素イオンで構成されています。構造のイオン性は、KCl が水に溶解すると良好な電気伝導体であることを意味します。
| 外観 | 白色の結晶固体 |
| 比重 | 1.98g/cm3 |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 74.55g/モル |
| 密度 | 1.98g/cm3 |
| 融合点 | 770°C (1,418°F) |
| 沸点 | 1420°C (2588°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 34.7g/100ml (0℃) |
| 溶解性 | 水、グリセロール、ホルムアミドに可溶。エタノールにわずかに溶ける |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | -1.8 (共役酸) |
| pH | 7 (10% 溶液) |
塩化カリウムの安全性と危険性
塩化カリウム (KCl) には潜在的な危険性と安全性に関する懸念があり、取り扱いまたは使用する際には考慮する必要があります。皮膚や目に炎症を引き起こす可能性があり、長時間暴露すると化学火傷を引き起こす可能性があります。 KCl 粉塵を吸入すると、呼吸器への刺激や咳を引き起こす可能性があります。さらに、大量の KCl を摂取すると、電解質の不均衡や不整脈を引き起こす可能性があります。手袋や保護眼鏡などの適切な個人用保護具を着用し、換気の良い場所で KCl を取り扱うことが重要です。皮膚や目に入った場合は、患部をよく洗い流し、必要に応じて医師の診察を受けることが重要です。
| ハザードシンボル | なし |
| セキュリティの説明 | 皮膚や目の炎症を引き起こします。飲み込むと有害。 |
| ID | UN1480 |
| HSコード | 310420 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | LD50 (ラット、経口): 2,500 mg/kg |
塩化カリウムの合成法
塩化カリウム (KCl) は、次のようないくつかの方法で合成できます。
- 可溶化と結晶化: この方法では、KCl を水に溶解し、溶液を蒸発させて固体の KCl 結晶を残します。
- イオン交換: KCl を生成するには、塩化ナトリウムなどの別の塩の溶液中のイオンをカリウム イオンと交換します。業界では、KCl 肥料の製造にこの方法が一般的に使用されています。
- 電気分解: KCl 溶液の電気分解では、カリウム元素と塩素ガスが生成され、これらが結合して KCl が形成されます。
- 水酸化カリウムと塩酸の反応: 水酸化カリウムは塩酸と反応して、KCl と水を生成します。
- 炭酸カリウムと塩酸の反応: 炭酸カリウムは塩酸と反応して、KCl、二酸化炭素、水を生成します。
各方法には独自の長所と短所があり、方法の選択は、製品の必要な純度、生産規模、原材料と設備のコストなどの要因によって決まります。
塩化カリウムの用途
塩化カリウムには次のような幅広い用途があります。
- 肥料:植物の成長に必要な栄養素を提供する肥料として使用されます。
- 食品添加物:ナトリウム摂取量を減らすために、加工食品の塩の代替品として使用されます。
- 水処理: 腐食やスケールの形成を防ぐために水処理システムに追加されます。
- 医療用途: 電解質を補充し、低カリウム血症などの症状を治療するために、静脈内輸液および経口補水液に使用されます。
- 産業用途: ガラス、セラミック、石鹸の製造、およびその他の化学物質の製造の原料として使用されます。
- 動物飼料: 必須栄養素を提供するために動物飼料に添加されます。
- 除氷剤:道路や歩道の氷や雪を溶かす除氷剤として使用されます。
- 石油およびガスの掘削: 石油およびガスの掘削作業で粘土安定剤として使用されます。
- 実験用試薬: 実験室での実験や分析で試薬として使用されます。
質問:
Q: 塩化カリウムとは何ですか?
A: 塩化カリウム (KCl) は、カリウムイオンと塩素イオンから構成される白色の結晶塩です。農業、食品、医療、化学製造などの産業で多くの用途があります。
Q: 塩化カリウムは何に使われますか?
A: 塩化カリウムは、肥料、食品添加物として、また低カリウム血症などの症状を治療するための医療用途として一般的に使用されています。水処理、工業プロセス、動物の餌やり、除氷、石油およびガスの掘削、実験室実験にも使用できます。
Q: 塩化カリウムは安全ですか?
A: 塩化カリウムは、大量に摂取したり、目や皮膚に接触したりすると有害となる可能性があります。塩化カリウムを取り扱いまたは使用する場合は、適切な安全ガイドラインと規制に従うことが重要です。
Q: KClは水に溶けますか?
A: はい、KCl は水によく溶けます。室温では、1 グラムの KCl が 1.5 ml の水に溶解します。
Q: KCl はイオン性ですか、それとも共有結合性ですか?
A: KCl は、イオン結合によって結合された正に帯電したカリウム イオンと負に帯電した塩化物イオンで構成されているため、イオン性化合物です。
Q: KCl は酸ですか、それとも塩基ですか?
A: 塩化カリウムは中性の化合物であり、酸でも塩基でもありません。
Q: KCl は強電解質ですか?
A: はい、KCl は水に溶解するとカリウムと塩化物イオンに完全に解離し、電気伝導性を可能にするため、強力な電解質です。
