硫酸マグネシウム (硫酸塩) または MgSo4 は、マグネシウム、硫黄、酸素で構成される化合物です。一般的に、下剤、抗けいれん剤として、またマグネシウム欠乏症の治療に医学的に使用されています。
| IUPAC名 | 硫酸マグネシウム |
| 分子式 | MgSO4 |
| CAS番号 | 7487-88-9 |
| 同義語 | エプソム塩;イギリスの塩。苦い塩。バスソルト;エプソム塩;サル・アングリクム。硫酸マグネシウム七水和物 |
| インチチ | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
硫酸マグネシウムの配合
硫酸マグネシウムの化学式はMgSO4です。この式は、硫酸マグネシウムがマグネシウムカチオン(Mg2+)と硫酸アニオン(SO42-)から構成されていることを示しています。硫酸マグネシウムの式は、化学反応に必要な物質の量を決定するのに役立つため、化学計算において重要です。
MgSO4 モル質量
硫酸マグネシウムのモル質量は 120.366 g/mol です。この値は、1 つのマグネシウム原子 (24.305 g/mol)、1 つの硫黄原子 (32.066 g/mol)、および 4 つの酸素原子 (それぞれ 15.999 g/mol) の原子質量を追加することによって計算されます。モル質量は、化学反応に必要な物質の量を決定するのに役立つため、化学計算において重要なパラメーターです。
硫酸マグネシウムの沸点
硫酸マグネシウムの沸点は化合物の状態によって異なります。硫酸マグネシウムには、無水物と七水和物の 2 つの形態が存在します。無水物は沸点が 1.124 °C (2.055 °F) と高く、七水和物は沸点が 150 °C (302 °F) と低くなります。硫酸マグネシウムの沸点は、圧力や不純物などの要因によって影響を受ける可能性があります。
硫酸マグネシウムの融点
硫酸マグネシウムの融点は化合物の状態にも依存します。無水形態の融点は 1.124 °C (2.055 °F) と高く、七水和物形態の融点は 150 °C (302 °F) と低くなります。硫酸マグネシウムの融点は、圧力や不純物などの要因によっても影響を受ける可能性があります。
硫酸マグネシウムの密度 g/ml
硫酸マグネシウムは化合物の状態によって密度が異なります。無水物の密度は 2.66 g/cm3 ですが、七水和物の密度は 1.68 g/cm3 です。密度は、単位体積あたりの質量を示す物質の物理的特性です。硫酸マグネシウムの密度は、化学反応に必要な物質の体積を計算するために使用できます。
硫酸マグネシウムの分子量
硫酸マグネシウムの分子量は 120,366 g/mol です。この値は、1 つのマグネシウム原子 (24.305 g/mol)、1 つの硫黄原子 (32.066 g/mol)、および 4 つの酸素原子 (それぞれ 15.999 g/mol) の原子質量を追加することによって計算されます。分子量は、化学反応に必要な物質の量を決定するのに役立つため、化学計算において重要なパラメーターです。
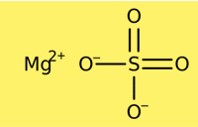
硫酸マグネシウムの構造
硫酸マグネシウムは結晶構造を持っています。無水物は菱面体晶の結晶構造を持ち、七水和物は単斜晶系の結晶構造を持ちます。硫酸マグネシウムの結晶構造は、マグネシウムカチオンと硫酸アニオンで構成されています。無水型には細胞あたり 1 つのマグネシウム陽イオンと 1 つの硫酸陰イオンが含まれますが、七水和物型には細胞あたり 1 つのマグネシウム陽イオンと 2 つの硫酸陰イオンが含まれます。
| 外観 | 白色の結晶固体 |
| 比重 | 2.66 (無水) 1.68 (七水和物) |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 120,366 g/モル |
| 密度 | 2.66 g/cm3 (無水) 1.68 g/cm3 (七水和物) |
| 融合点 | 1124℃(無水) 150℃(七水和物) |
| 沸点 | 1124℃(無水) 150℃(七水和物) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 71.6g/100ml (20℃) |
| 溶解性 | 水とエタノールに溶ける |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| PKa | 9.99 |
| pH | 6.0 – 8.0 (5%溶液) |
硫酸マグネシウムの安全性と危険性
硫酸マグネシウムは一般に、正しく取り扱われれば安全であると考えられています。ただし、慎重に扱わないと、特定の危険が生じる可能性があります。硫酸マグネシウムの粉塵にさらされると、目、皮膚、呼吸器系を刺激する可能性があります。硫酸マグネシウムを大量に摂取または注射すると、下痢、腹痛、脱水症状を引き起こす可能性があります。硫酸マグネシウムを扱うときは、皮膚や目の炎症を避けるために、手袋やゴーグルなどの保護具を着用することが重要です。飲み込んだり暴露した場合は、直ちに医師の診察を受けてください。硫酸マグネシウムは、熱源や不適合物質から離れた、涼しく乾燥した場所に保管する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | S22 – 粉塵を吸い込まないでください。 S24/25 – 皮膚や目との接触を避けてください。 S36 – 適切な保護服を着用してください。 S26 – 目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。 S45 – 事故が発生した場合、または気分が悪くなった場合は、直ちに医師の診察を受けてください(可能であれば医師にラベルを見せてください) |
| AN識別子 | UN3077 |
| HSコード | 28332100 |
| 危険等級 | 9 |
| 梱包グループ | Ⅲ |
| 毒性 | LD50 (経口、ラット) > 3,000 mg/kg; LD50 (皮膚、ラット) > 2,000 mg/kg |
硫酸マグネシウムの合成法
硫酸マグネシウム (MgSO4) を合成するにはさまざまな方法が存在します。
一般的な方法は、酸化マグネシウムまたは水酸化マグネシウムを硫酸と反応させることです。このプロセスでは、混合物が完全に溶解するまで撹拌しながら、酸化マグネシウムまたは水酸化マグネシウムを硫酸に加えます。溶液を蒸発させて過剰な水を除去し、MgSO4 マグネシウム結晶を収集します。
別のアプローチは、完全に溶解するまで撹拌しながら炭酸マグネシウムを硫酸にゆっくりと添加することです。 MgSO4 マグネシウム結晶を得るには、得られた溶液を濾過してすべての不純物を除去し、蒸発させます。
マグネシウムを硫酸と反応させ、反応が完了するまで混合物を加熱し、その後濾過し、得られた溶液を蒸発させてマグネシウム MgSO4 結晶を取得します。
塩化マグネシウムとナトリウム MgSO4 を反応させることでもマグネシウム MgSO4 を得ることができます。このプロセスには、塩化マグネシウムをナトリウム MgSO4 溶液に加え、得られた混合物を撹拌し、マグネシウム MgSO4 結晶が形成されるまで加熱することが含まれます。
硫酸マグネシウムの用途
硫酸マグネシウム (MgSO4) は、さまざまな分野で多くの用途があります。その用途には次のようなものがあります。
- 医療用途: 妊娠中の子癇および子癇前症の治療薬として、また重度の喘息や低マグネシウム血症患者の発作を予防するために使用されます。それは下剤および下剤として機能します。
- 農業: マグネシウムと硫黄の含有量が高いため、肥料として使用されます。農家は土壌中のマグネシウム欠乏を修正するためにそれを使用しています。
- 食品および飲料産業: 水の化学的性質を調整し、風味を改善するためにビール製造の醸造塩として使用されます。食品業界では豆腐の製造における凝固剤として使用されています。
- 工業用途:乾燥剤、乾燥剤、難燃剤として使用されます。さまざまな業界で繊維、紙、化学品の製造に使用されています。
- パーソナルケア: 人々は、筋肉の痛みや凝りを軽減するなど、健康上の利点を主張するために、バスソルトや足湯に硫酸マグネシウムを使用しています。
- その他の用途: 顔料、爆薬の製造、金属の精製に使用されます。
質問:
Q: 歯磨き粉に使用される基剤とは何ですか?
A: 歯磨き粉に最も一般的に使用される基剤は通常、炭酸カルシウムまたは重炭酸ナトリウムです。これらのベースは歯をこすり、歯垢を除去するのに役立ちます。
Q: 硫酸マグネシウムは何に使用されますか?
A: 硫酸マグネシウムには、妊娠中の子癇や子癇前症の治療、下剤や下剤、肥料、醸造塩、難燃剤、乾燥剤など、さまざまな用途があります。繊維、紙、化学薬品の製造にも使用されます。
Q: 硫酸マグネシウムは溶けますか?
A: 硫酸マグネシウムは水とアルコールに溶けます。
Q: 硫酸マグネシウムは水に溶けますか?
A: はい、硫酸マグネシウムは水への溶解度が高く、室温での溶解度は約 25.5 g/100 ml です。
Q: 硫酸マグネシウムは何に使用されますか?
A: 硫酸マグネシウムには、特定の用途に応じてさまざまな用途と利点があります。その用途には、医療、肥料、醸造塩、難燃剤、乾燥剤などがあります。医学的には、硫酸マグネシウムは、発作の予防、便秘の治療、筋肉の痛みや凝りの軽減に使用できます。
