炭酸 (H2CO3) は、二酸化炭素が水に溶解すると形成され、海洋の pH を調整し、岩石の風化を制御する上で重要な役割を果たします。
| IUPAC名 | 炭酸 |
| 分子式 | H2CO3 |
| CAS番号 | 463-79-6 |
| 同義語 | 酸っぱい空気。酸っぱい空気。 H2CO3;オキシダニウムミリデンメタン;酸性炭酸塩;ヒドロキシケトン;ジヒドロキシメタノン |
| インチチ | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
炭酸配合
炭酸の化学式は H2CO3 で、水素原子 2 つ、炭素原子 1 つ、酸素原子 3 つで構成されていることを示します。この式は、分子内の原子の比率も示しています。これは、炭酸が関与する化学反応の化学量論を決定するために重要です。
炭酸のモル質量
炭酸のモル質量は約 62.03 g/mol です。二酸化炭素が水に溶解するときに形成される弱酸であり、海のpHを調整する役割を果たします。炭酸のモル質量は、溶液中で特定の pH に達するのに必要な酸の量を計算したり、水にどの程度の二酸化炭素が溶解できるかを決定したりするために重要です。
炭酸の沸点
炭酸は沸点に達する前に水と二酸化炭素に分解されるため、明確に定義された沸点はありません。ただし、大気圧では、炭酸は約 333 K (60 °C) の温度で水と二酸化炭素に分解します。
炭酸の融点
炭酸も、融点に達する前に水と二酸化炭素に分解されるため、明確に定義された融点はありません。ただし、大気圧では、炭酸は約 273 K (-0.15 °C) の温度で水と二酸化炭素に分解します。
炭酸密度 g/ml
炭酸の密度は室温(25℃)で約1.67 g/mLです。この値は、溶液の濃度だけでなく、環境の温度や圧力によっても変化します。
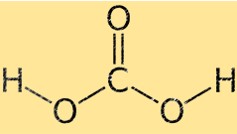
炭酸の構造
炭酸は四面体の分子幾何学を持ち、中心に炭素原子があり、四面体の隅に周囲の 4 つの原子 (酸素 2 個と水素 2 個) が配置されています。 2 つの酸素原子は二重結合によって炭素原子に結合しており、2 つの水素原子は単結合によって結合しています。
炭酸の分子量
炭酸の分子量は 62.03 g/mol です。この値は、構成元素である水素 (H)、炭素 (C)、酸素 (O) の原子量を加算して計算されます。
| 外観 | 無色の液体または結晶固体 |
| 比重 | 1.67 g/cm3 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 62.03 g/モル |
| 密度 | 室温(25℃)で1.67 g/mL |
| 融合点 | 約 273 K (-0.15 °C) で分解します。 |
| 沸点 | 約 333 K (60°C) で分解します。 |
| フラッシュドット | 適用できない |
| 水への溶解度 | 完全に溶ける |
| 溶解性 | 水、エタノール、メタノールに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 3.6 (最初の解離) |
| pH | 5.6 (0.1M溶液中) |
炭酸の安全性と危険性
炭酸 (H2CO3) は一般に安全であると考えられていますが、特定の状況では危険を引き起こす可能性があります。 H2CO3 にさらされると、目、皮膚、呼吸器系に炎症を引き起こし、咳、喘鳴、息切れを引き起こす可能性があります。 H2CO3 を摂取すると、胃の不調、吐き気、嘔吐を引き起こす可能性があります。 H2CO3 も弱酸であり、アルミニウムや亜鉛などの特定の金属と反応して可燃性の水素ガスを生成する可能性があります。 H2CO3 を扱ったり使用したりする場合は、保護服の着用や十分な換気など、適切な安全対策を講じる必要があります。暴露した場合は、直ちに医師の診察を受ける必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | 無毒 |
| 国連識別番号 | 1824年 |
| HSコード | 28111990 |
| 危険等級 | 8 – 腐食性物質 |
| 梱包グループ | Ⅲ |
| 毒性 | 低毒性 |
炭酸の合成法
H2CO3 はさまざまな方法で合成できます。一般的な方法は、触媒の存在下で二酸化炭素 (CO2) と水 (H2O) を反応させることです。このプロセスは水和と呼ばれ、炭酸を生成します。
CO2 + H2O → H2CO3
炭酸を合成する別の方法には、炭酸カルシウム (CaCO3) と塩酸 (HCl) などの酸を反応させることが含まれます。このプロセスは酸性化と呼ばれ、炭酸が生成されます。
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
シュウ酸と炭酸ナトリウム (Na2CO3) などの炭酸塩との反応により、炭酸が合成されます。このプロセスでは、炭酸とシュウ酸ナトリウムなどの塩が生成されます。
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
ソルベイプロセスでは、水の存在下で炭酸ナトリウム(Na2CO3)と二酸化炭素を反応させることにより、炭酸と重炭酸ナトリウムを生成します。
2NaHCO3 + CO2 → Na2CO3 + H2CO3
全体として、炭酸の合成にはいくつかの方法が利用可能ですが、それぞれに独自の利点と制限があります。方法の選択は、製品の望ましい純度、原材料の入手可能性、必要な生産規模などの要因によって異なります。
炭酸の用途
炭酸 (H2CO3) は、産業、医療、日常生活で多くの用途がある多用途の化合物です。 H2CO3 の主な用途には次のようなものがあります。
- 炭酸飲料: H2CO3 は、ソーダやビールなどの炭酸飲料の特徴的なシュワシュワ感の原因となる化合物です。
- H2CO3 は、水処理や食品加工などのさまざまな工業プロセスで pH を緩衝します。
- 酸素を置換し、燃焼を防ぐことで火災を抑制します。
- H2CO3 は、特定の種類の食品内の細菌やカビの増殖を抑制し、食品を保存します。
- 特に鉱物の沈着物を除去する穏やかな洗浄剤として機能します。
- 医療専門家は、特定の皮膚病変の治療や肺機能検査中の気管支収縮の誘発など、特定の用途で H2CO3 を使用します。
- 溶接工は、酸化を防止し、よりきれいな溶接を行うために、シールド ガスとして H2CO3 を使用します。
全体として、炭酸はさまざまな分野で幅広い用途を持つ有用で多用途な化合物です。
質問:
Q:炭酸は強酸ですか?
A: 炭酸は弱酸です。つまり、水中では部分的にのみ解離して、水素イオン (H+) と重炭酸イオン (HCO3-) を生成します。その酸解離定数 (Ka) は比較的低く、水中で完全には解離しないことを示しています。
Q: 二酸化炭素は酸性ですか?
A: 二酸化炭素 (CO2) は、水中に水素イオン (H+) を生成しない中性の化合物であるため、本質的に酸性ではありません。しかし、CO2 が水に溶解すると、水分子と反応して弱酸である炭酸を形成することがあります。この反応により pH が低下し、溶液がより酸性になることがあります。したがって、CO2 自体は酸性ではありませんが、水と反応すると溶液が酸性になることがあります。
