塩化アンモニウムまたはNH4Clは、医薬品や肥料などのさまざまな用途に使用される白色の結晶塩です。アンモニアと塩酸の反応によって生成され、独特の塩味があります。
| IUPAC名 | 塩化アンモニウム |
| 分子式 | NH4Cl |
| CAS番号 | 12125-02-9 |
| 同義語 | サルアンモニア、サルミアック、ヌシャディル塩、アムクロル、サル・アルマニャック、塩酸塩、ムリウム酸アンモニウム、サル・アルマニャック |
| インチチ | InChI=1S/ClH・H3N/h1H;1H3 |
NH4Cl モル質量
塩化アンモニウムのモル質量は 53.49 g/mol です。モル質量とは、物質 1 モルの質量を指し、モルあたりのグラム数 (g/mol) で表されます。塩化アンモニウムのモル質量は、その構成原子である窒素 (N)、水素 (H)、塩素 (Cl) の原子質量を加算することによって決定されます。塩化アンモニウムの分子式は NH4Cl で、窒素原子 1 つ、水素原子 4 つ、塩素原子 1 つが含まれていることを意味します。したがって、塩化アンモニウムのモル質量は次のように計算できます。
モル質量 = (1 x N の原子量) + (4 x H の原子量) + (1 x Cl の原子量)
= (1 x 14.01 g/mol) + (4 x 1.01 g/mol) + (1 x 35.45 g/mol)
= 53.49 g/モル
塩化アンモニウムの沸点
塩化アンモニウムの沸点は 520°C (968°F) です。沸点は、液体の蒸気圧がそれに加えられる外部圧力と等しくなる温度です。この温度では、塩化アンモニウムは蒸発して気体状態に変わります。塩化アンモニウムの沸点が高いのは、アンモニウム (NH4+) イオンと塩化物 (Cl-) イオン間の強力なイオン結合によるものです。
塩化アンモニウムの融点
塩化アンモニウムの融点は 338°C (640°F) です。融点とは、固体が液体に変わる温度です。この温度では、アンモニウム (NH4+) イオンと塩化物 (Cl-) イオン間のイオン結合が切断され、塩化アンモニウムは固体から液体に変化します。塩化アンモニウムは他のイオン性化合物に比べて融点が比較的低いため、溶接や冶金などの特定の用途に役立ちます。
塩化アンモニウムの密度 g/ml
塩化アンモニウムの密度は 1.527 g/cm3 です。密度は、物質の単位体積あたりの質量の尺度です。塩化アンモニウムの高密度は、その非常に緻密なイオン格子構造によるものです。塩化アンモニウムは水よりも密度が高いため、水に沈みます。
塩化アンモニウムの分子量
塩化アンモニウムの分子量は 53.49 g/mol です。分子量は、分子内のすべての原子の原子量の合計です。塩化アンモニウムの分子量はそのモル質量と同じです。
塩化アンモニウムの構造
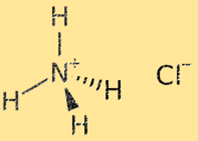
塩化アンモニウムの構造は、アンモニウム (NH4+) イオンと塩化物 (Cl-) イオンが交互に並んだ結晶格子です。アンモニウム イオンは、正電荷 (+1) を持つ多原子イオンで、1 つの窒素原子と 4 つの水素原子から構成されます。塩化物イオンは、塩素原子からなる負の電荷 (-1) を持つ単原子イオンです。塩化アンモニウムの結晶格子構造は、アンモニウムイオンと塩化物イオンの間の強いイオン結合によって安定化しており、その結果、非常に安定で脆い固体が得られます。
塩化アンモニウムの配合
塩化アンモニウムの式はNH4Clです。アンモニウムイオン(NH4+)と塩化物イオン(Cl-)で構成されています。この式は分子内の原子の比率を表し、アンモニウム イオンごとに塩化物イオンが 1 つ存在することを示しています。塩化アンモニウムの式は、化合物のモル質量、密度、その他の特性を決定するために使用されます。
| 外観 | 白色の結晶固体 |
| 比重 | 1,527 g/cm3 |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 53.49 g/モル |
| 密度 | 1,527 g/cm3 |
| 融合点 | 338°C (640°F) |
| 沸点 | 520°C (968°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 29.7g/100ml (25℃) |
| 溶解性 | エタノール、アセトンに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| PKa | 午前9時25分 |
| pH | 4.6 (5%溶液) |
塩化アンモニウムの安全性と危険性
塩化アンモニウム (NH4Cl) は通常、通常の使用では安全であると考えられています。ただし、大量に摂取または吸入すると有害になる可能性があります。 NH4Cl を摂取すると、口や喉の炎症、吐き気、嘔吐、下痢を引き起こす可能性があります。 NH4Cl を吸入すると、呼吸器系の炎症、咳、息切れを引き起こす可能性があります。 NH4Cl は皮膚や目に炎症を引き起こす可能性があるため、慎重に取り扱う必要があります。目、鼻、喉を刺激する可能性がある NH4Cl 粉塵や蒸気への曝露を避けることも重要です。 NH4Cl を取り扱うときは、手袋やゴーグルなどの適切な個人用保護具を着用する必要があります。
| ハザードシンボル | XI |
| セキュリティの説明 | S22、S24/25、S36/37/39 |
| 国連識別番号 | 国連 3077 |
| HSコード | 2827.10.00 |
| 危険等級 | 9 – その他の危険物 |
| 梱包グループ | Ⅲ |
| 毒性 | 毒性は低いですが、大量に飲み込んだり吸入したりすると有害となる可能性があります。 |
塩化アンモニウムの合成方法
塩化アンモニウム (NH4Cl) はさまざまな方法で合成できます。
- 一般的な方法は、水中でアンモニアガスと塩酸を反応させることです。この発熱反応により、白色の結晶性固体の形で NH4Cl が生成されます。発生する熱による飛び散りを避けるため、撹拌しながら塩酸をゆっくりと水に加えることが重要です。
- NH4Cl を製造する別の方法は、炭酸ナトリウムの製造やソルベイプロセスなどのさまざまな工業プロセスの副産物としてです。
- NH4Cl を合成する別の方法は、アンモニアと塩化ナトリウムを反応させることです。この反応では、NH4Cl と水酸化ナトリウムの両方が生成されます。この反応は発熱性であり、望ましくない副生成物の生成を避けるために慎重な制御が必要です。
塩化アンモニウムの用途
塩化アンモニウム (NH4Cl) は、さまざまな業界で多くの用途があります。
- NH4Cl は農業における肥料として機能し、窒素や塩化物などの必須栄養素を作物に提供し、それによって収量と品質を向上させます。
- 塩化アンモニウムは、電解質として電気を伝導することにより、乾電池の適切な機能を促進します。
- 繊維産業では、NH4Cl を染色および印刷剤として使用しており、染料を生地に定着させ、色堅牢度を向上させるのに役立ちます。
- 金属加工やはんだ付けのフラックスとして、NH4Cl は金属から酸化層を除去し、溶接を容易にします。
- この化学物質は、食品、医薬品、化粧品において、香味料、咳止め薬の去痰剤、パーソナルケア製品の成分として用途があります。
全体として、NH4Cl はそのユニークな特性により、さまざまな業界で多くの重要な用途を持つ多用途の化学物質となっています。
質問:
Q: 塩化アンモニウムは昇華しますか?
A: はい、塩化アンモニウムは昇華することが知られています。つまり、固相から気相までの間に溶融することなく直接移行することができます。
Q: NH4Cl は酸性ですか、それとも塩基性ですか?
A: 塩化アンモニウムは酸性の塩です。水に溶解すると加水分解が起こり、酸性溶液が生成されます。これは、アンモニウム イオンが弱酸として作用し、水分子にプロトン (H+) を与えるためです。
Q: 塩化アンモニウムの式は何ですか?
A: 塩化アンモニウムの式は NH4Cl です。これは、イオン結合によって結合されたアンモニウム イオン (NH4+) と塩化物イオン (Cl-) で構成されています。
Q: 塩化アンモニウムは水に溶けますか?
A: はい、塩化アンモニウムは水によく溶けます。室温では、約 29.7 グラムの塩化アンモニウムが 100 ミリリットルの水に溶解します。
Q: 塩化アンモニウムと塩化ナトリウムを分離するにはどうすればよいですか?
A: 塩化アンモニウムと塩化ナトリウムを分離する方法の 1 つは昇華です。これは、混合物を加熱して塩化アンモニウムを昇華させ、塩化ナトリウムは固体のままにすることで実現できます。昇華した塩化アンモニウムは収集され、固体の形に再凝縮されます。別の方法は、混合物を水に溶解し、特定の試薬または pH 調整を使用して塩の 1 つを選択的に沈殿させることです。
