二塩基性リン酸ナトリウムまたは Na2HPO4 は、研究室で緩衝剤として一般的に使用される化合物です。また、食品添加物として一部の食品および飲料製品に含まれる場合もあります。
| IUPAC名 | リン酸水素二ナトリウム |
| 分子式 | Na2HPO4 |
| CAS番号 | 7558-79-4 |
| 同義語 | リン酸水素ナトリウム、リン酸二ナトリウム、第二リン酸ナトリウム、第二リン酸ナトリウム無水、第二リン酸ナトリウム七水和物 |
| インチチ | InChI=1S/2Na・H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Na2HPO4 モル質量
二塩基性リン酸ナトリウムのモル質量は 141.96 g/mol です。この値は、化合物に存在するナトリウム (Na)、リン (P)、酸素 (O) の各元素の原子量を加算することによって計算されます。モル質量は、反応の実行や特定の濃度の溶液の調製に必要な物質の量を決定するなど、さまざまな計算で使用される重要なパラメーターです。
リン酸二ナトリウムの処方
第二リン酸ナトリウムの化学式は Na2HPO4 です。この式は、化合物中に存在する各元素の割合を表します。式は、反応性や溶解度など、化合物の化学的特性を決定する際に重要です。
リン酸ナトリウムの二塩基性沸点
二塩基性リン酸ナトリウムは沸点に達する前に分解するため、明確な沸点がありません。ただし、第二リン酸ナトリウムの分解温度は約 155°C になります。この値を超える温度では、化合物はその構成イオンであるナトリウムとリン酸塩に分解され始めます。この特性により、高温への加熱が必要な用途での使用には適していません。
第二リン酸ナトリウムの融点
Na2HPO4 の融点は、それが存在する形態によって異なります。この化合物の無水形態の融点は 358°C ですが、七水和物形態の融点は 93°C と低くなります。融点は、物質の識別と特性評価に使用される重要な物理的特性です。
リン酸ナトリウムの二塩基性密度 g/ml
Na2HPO4 の密度は、Na2HPO4 が存在する形態によって異なります。この化合物の無水形態の密度は 1.7 g/mL ですが、七水和物形態の密度は 1.68 g/mL と低くなります。密度は、物質の特定の体積に含まれる質量の量を表す物理的特性です。
リン酸ナトリウムの二塩基性分子量
Na2HPO4 の分子量は 141.96 g/mol です。この値は、化合物に存在する各元素の原子量を加算することによって計算されます。分子量は、反応の実行や特定の濃度の溶液の調製に必要な物質の量を決定するなど、さまざまな計算に使用される重要なパラメーターです。
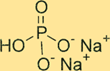
リン酸ナトリウムの二塩基構造
Na2HPO4 は結晶構造を持っています。化合物の無水形は白色で無臭の粉末ですが、七水和物形は無色透明の結晶です。この化合物はリン原子の周りに四面体の形状をしており、各酸素原子は四面体の角に位置しています。ナトリウムイオンは四面体間の隙間に存在します。
| 外観 | 白い粉末または透明な結晶 |
| 比重 | 1.68 – 1.7 g/mL |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 141.96 g/モル |
| 密度 | 1.68 – 1.7 g/mL |
| 融合点 | 無水物:358℃、七水和物:93℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水に可溶、エタノールに不溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| PKa | 2.15 (リン酸イオン) |
| PH | 8.0~11.0(0.1M水溶液) |
第二リン酸ナトリウムの安全性と危険性
第二リン酸ナトリウム (Na2HPO4) は一般に、さまざまな用途での使用が安全であると考えられていますが、皮膚や目に炎症を引き起こす可能性があります。粉末状の化合物を吸入すると、呼吸器への刺激を引き起こす可能性があります。 Na2HPO4 は強酸や酸化剤と激しく反応する可能性があり、高温に加熱すると有毒なフュームを放出する可能性があります。すべての化学物質と同様に、この化合物を取り扱うときは、防護服や手袋を着用し、換気の良い場所で作業するなど、適切な予防措置を講じる必要があります。皮膚や目に入った場合は、多量の水で洗い流し、必要に応じて医師の診察を受けてください。
| ハザードシンボル | なし |
| セキュリティの説明 | S22 – 粉塵を吸い込まないでください。 S24 – 皮膚との接触を避けてください。 S37 – 適切な手袋を着用してください。 |
| AN識別子 | UN3077 |
| HSコード | 28352200 |
| 危険等級 | 9 |
| 梱包グループ | Ⅲ |
| 毒性 | LD50 (ラット、経口) – 3,400 mg/kg |
第二リン酸ナトリウムの合成方法
二塩基性リン酸ナトリウム (Na2HPO4) は、リン酸と水酸化ナトリウムの反応、リン酸の炭酸ナトリウムまたは重炭酸ナトリウムによる中和、一塩基性リン酸ナトリウムと水酸化ナトリウムの反応など、いくつかの方法で合成できます。
- 一般的な方法は、リン酸と水酸化ナトリウムを 1:2 の比率で反応させて、Na2HPO4 と水を生成することです。反応は室温または穏やかな加熱下で行うことができ、得られた生成物は結晶化または蒸発によって精製されます。
- 別の方法は、リン酸を炭酸ナトリウムまたは重炭酸ナトリウムで中和し、その後、Na2HPO4 を沈殿させることです。炭酸ナトリウムまたは重炭酸ナトリウムを使用して反応混合物のpHを約8〜9に調整し、得られた沈殿を収集し、水で洗浄して不純物を除去する。
- 3 番目の方法では、一塩基性リン酸ナトリウムと水酸化ナトリウムを 1:1 の比率で反応させ、Na2HPO4 と水が生成します。次いで、得られた生成物を結晶化または蒸発によって精製する。
方法の選択は、目的の純度、収率、費用対効果などの要因によって異なります。 Na2HPO4 の合成はいくつかの方法で実行できますが、それぞれに独自の利点と制限があります。
第二リン酸ナトリウムの用途
第二リン酸ナトリウムは、さまざまな業界で多くの用途があります。
- 食品業界では、乳化剤、緩衝剤、増粘剤として使用されています。金属イオンが他の食品成分と反応するのを防ぎ、食品の品質と安定性を維持するのに役立つ金属イオン封鎖剤として機能します。ベーキングパウダーの脱離剤として、また乳製品の pH 調整剤として機能します。
- 医療業界では、結腸の水分量を増やすことで便秘を治療する下剤として使用されています。また、pH調整剤や緩衝剤として医薬品や注射剤の調製にも使用されます。
- 農業産業では、植物にリンを供給する肥料として機能します。
- また、動物の飼料に含まれる栄養補助食品としても機能します。
- 水処理業界では、ボイラーや冷却システムの腐食防止剤およびスケール防止剤として Na2HPO4 を使用しています。
- 洗浄剤として機能し、表面からカルシウムとマグネシウムの堆積物を除去します。
質問:
Q: 第二リン酸ナトリウムは防腐剤ですか?
A: Na2HPO4 は通常、食品の防腐剤として使用されません。ただし、金属イオンが他の食品成分と反応するのを防ぎ、食品の品質と安定性を維持するのに役立つ金属イオン封鎖剤として機能します。
Q: 20% w/v 溶液 50 ml には二塩基性リン酸ナトリウム (分子量 141.98) が何モル含まれていますか?
A: Na2HPO4 の 20% w/v 溶液中のモル数を計算するには、まず重量/体積パーセンテージをグラム/100 ml に変換する必要があります。 20% w/v 溶液とは、100 ml の溶液中に 20 グラムの化合物が含まれることを意味します。したがって、50 ml の溶液には 10 グラムの Na2HPO4 が含まれます。モル数を計算するには、質量を分子量で割ります。
モル = 質量 / 分子量 モル = 10 g / 141.98 g/mol モル = 0.070 モル
したがって、20% w/v 溶液 50 ml には 0.070 モルの Na2HPO4 が存在します。
Q: 第二リン酸ナトリウムの密度はどれくらいですか?
A: Na2HPO4 の密度は、化合物の形態と濃度によって異なります。無水物の密度は約 2.36 g/cm3 ですが、七水和物の密度は約 1.62 g/cm3 です。溶液中では濃度に応じて密度が変化します。
