アンモニアとは何ですか?
アンモニアまたは NH3 は、窒素と水素から構成される無色の刺激性のガスで、冷媒、洗浄剤、肥料として産業界で広く使用されています。
| IUPAC名 | アンモニア |
| 分子式 | NH3 |
| CAS番号 | 7664-41-7 |
| 同義語 | アザン、三水素化窒素、ハーツホルンアルコール |
| インチチ | InChI=1S/NH3/c1-2 |
アンモニアの性質
アンモニアのルイス構造
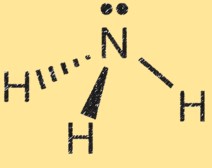
アンモニア (NH3) のルイス構造は、分子内の電子の配置を示します。ルイス構造では、点は電子を表し、線は原子間の結合を表します。
アンモニアのルイス構造は、窒素原子が 3 つの水素原子に囲まれ、窒素原子と水素原子の間で共有される一対の電子を示します。これは分子内の共有結合を表します。窒素原子には 5 つの価電子があり、水素原子にはそれぞれ 1 つの価電子があります。アンモニアのルイス構造では、窒素原子は水素原子と 3 つの単結合を形成し、1 つの非共有電子対を持っています。
アンモニアの配合
アンモニアの化学式はNH3です。この式は、各アンモニア分子には 3 つの水素原子と 1 つの窒素原子があることを示しています。式は物質の組成を表し、その特性と挙動に関する重要な情報を提供します。
NH3 モル質量
物質のモル質量は、物質 1 モルの質量であり、モルあたりのグラム数で表されます。アンモニア (NH3) のモル質量は 17.0307 g/mol です。これは、1 モルのアンモニアの質量が 17.0307 グラムであることを意味します。物質のモル質量は、特定のサンプル内のモル数を決定する際に重要であり、化合物の式質量を決定するために使用できます。
アンモニアの沸点
NH3 の沸点は -33.34°C (-28.012°F) です。物質の沸点は、その蒸気圧が大気圧と等しくなり、液体から気体に変化し始める温度です。 NH3 の沸点は他の化学物質に比べて比較的低いため、冷却および冷凍システムで有用な冷媒となっています。
NH3 融点
NH3 の融点は -77.73°C (-107.87°F) です。物質の融点は、固体から液体に変化する温度です。 NH3 は融点が低いため、気体から液体に容易に凝縮でき、状態が変化するときに熱を吸収できるため、有用な冷媒となります。
NH3 密度 g/ml
物質の密度は、単位体積あたりのサンプルの質量です。 NH3 の密度は 0.769 g/mL です。これは、1 ミリリットルの NH3 の質量が 0.769 グラムであることを意味します。物質の密度は、特定の体積内に存在する物質の量を決定するために使用でき、物質がさまざまな状態でどのように動作するかを理解するための重要な特性です。
NH3 分子量
物質の分子量は、その物質の単一分子内のすべての原子の原子量の合計です。 NH3 (NH3) の分子量は 17.0307 g/mol です。これは、NH3 分子の分子量が 1 モルあたり 17.0307 グラムであることを意味します。物質の分子量は、特定のサンプル内のモル数を決定する際に重要であり、化合物の式質量を決定するために使用できます。
NH3構造
NH3 は 3 つの水素原子と 1 つの窒素原子から構成される分子です。窒素原子は水素原子と共有結合を介して結合しており、分子は三角錐の形状をしています。分子内の結合角は約 107°です。 NH3 は極性分子であり、プラス端とマイナス端を持ち、化学反応の溶媒および試薬として一般に使用されます。
| 外観 | 無色の気体 |
| 比重 | 0.59(空気=1) |
| 色 | 無色 |
| 匂い | 刺激的で強い臭気 |
| モル質量 | 17.0307 g/モル |
| 密度 | 0.769g/mL |
| 融合点 | -77.73℃ |
| 沸点 | -33.34℃ |
| フラッシュドット | 該当なし(ガス) |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水およびほとんどの有機溶媒に可溶 |
| 蒸気圧 | 50.7kPa(20℃) |
| 蒸気密度 | 0.59(空気=1) |
| pKa | 4.75 |
| pH | 11.6 (飽和溶液) |
アンモニアの安全性と危険性
NH3 は非常に有毒で腐食性のガスであり、適切に取り扱わないと人間の健康や環境に重大な害を及ぼす可能性があります。 NH3 は目、皮膚、気道に重度の火傷を引き起こす可能性があり、高濃度で吸入すると死に至る可能性もあります。さらに、NH3 は非常に反応性が高く、特定の化学物質や物質と接触すると発火または爆発する可能性があります。
NH3 を扱ったり作業したりする場合は、安全対策を講じることが重要です。これには、ガスの吸入を避けるための適切な換気の提供だけでなく、手袋、ゴーグル、フェイスマスクなどの防護服の着用も含まれます。 NH3 を熱源やその他の可燃物から離れた、換気の良い場所に保管することも重要です。 NH3 にさらされた場合は、汚染された衣類を脱ぎ、患部を多量の水で洗い流すことが重要です。暴露の症状が現れた場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | T+、N |
| セキュリティの説明 | 環境に危険、吸入すると有害、刺激性 |
| AN識別子 | 国連 1005 |
| HSコード | 2814.1 |
| 危険等級 | 2.3 |
| 梱包グループ | Ⅱ |
| 毒性 | 非常に有毒で致死量 (吸入) – 33 ~ 66 ppm |
アンモニアの合成法
アンモニアを合成するには、ハーバー法、オストワルド法、ビルケラント・アイデ法など、いくつかの方法があります。
ハーバー・ボッシュ法としても知られるハーバー法は、アンモニアの工業的合成に最も広く使用されている方法です。このプロセスでは、空気中の窒素ガスが鉄触媒上で水素ガスと反応してアンモニアが生成されます。反応は高圧 (約 150 気圧) および 450 ~ 500℃ の温度で行われます。ハーバープロセスは非常に効率的で、大量のアンモニアを高収率で生成し、肥料やその他の化学物質の生産のためのアンモニアの主な供給源として使用されます。
窒素固定法としても知られるオストワルド法は、窒素ガスを一酸化窒素に酸化し、続いて一酸化窒素をより多くの窒素ガスと反応させてアンモニアを形成する、アンモニア合成の古い方法です。このプロセスは効率が低いため、主にハーバー プロセスに置き換えられています。
プラズマプロセスとしても知られるビルケラント・アイデプロセスは、プラズマ放電を使用して窒素ガスと水素ガスを解離し、アンモニアを形成する新しいアンモニア合成方法です。このプロセスはまだ開発段階にあり、産業用途にはまだ広く採用されていません。
要約すると、ハーバー法はアンモニアの合成に最も一般的に使用される方法ですが、オストワルト法とビルケランド・アイデ法は古い方法であるか、あまり広く使用されていない方法です。
アンモニアの用途
アンモニアは、産業や農業で幅広い用途に使用される多用途化学物質です。アンモニアの主な用途には次のようなものがあります。
- 肥料の生産: 窒素肥料生産の主成分であるアンモニアは、作物の収量を増加させ、土壌の肥沃度を向上させます。
- 冷凍: 冷蔵庫や冷凍庫などの産業用および家庭用冷凍システムでは、冷媒としてアンモニアが使用されています。
- 洗浄: 家庭用洗浄製品には、油や汚れを分解する能力があるため、アンモニアが含まれていることがよくあります。
- 医薬品: 制酸薬や咳止めシロップなどのさまざまな医薬品の製造では、原料としてアンモニアが使用されます。
- 繊維製造: 繊維の染色や印刷、合成繊維の製造でもアンモニアが使用されます。
- 廃棄物処理: 下水処理場からの廃水処理と臭気制御には、アンモニアが使用されます。
- 難燃剤: アンモニアは、プラスチック、ゴムなどの材料の製造において難燃剤として機能します。
- 石油およびガスの生産: 石油およびガス産業では、界面活性剤や抗乳化剤などのさまざまな化学物質を製造するためにアンモニアが使用されます。
結論として、アンモニアは、農業、冷凍、クリーニング、医薬品、繊維製造、廃棄物処理、難燃剤、石油・ガス生産など、さまざまな産業や用途で幅広く使用される多用途化学物質です。
質問:
アンモニアは酸ですか、それとも塩基ですか?
アンモニアは塩基とみなされます。水溶液中では溶解して水酸化物イオン(OH-)を形成し、弱塩基として作用します。アンモニアの pH は塩基性 (アルカリ性) で、通常は約 11 です。アンモニア溶液は酸を中和して塩と水を形成します。これは塩基の特徴の 1 つです。化学反応では、アンモニアは求核試薬としても作用し、アミドを形成する反応に参加します。アミドはアンモニアの誘導体であり、アミンとアミドに特有の窒素-炭素結合を含みます。
アンモニアは極性ですか?
はい、アンモニアは極性です。それは、中央の窒素原子が 3 つの水素原子に囲まれた湾曲した分子構造を持っています。この形状は、双極子の正端が水素原子に位置し、負端が窒素原子に位置する永久双極子モーメントを作成します。アンモニアは極性があるため、水などの極性溶媒に溶解できます。これは極性分子の特徴です。アンモニアは極性があるため、極性分子間に発生する一種の分子間力である水素結合にも関与できます。この水素結合により、同様のサイズの非極性分子よりも沸点と融点が高くなる可能性があります。
