二酸化塩素または ClO2 は、水処理や食品の保存に使用される非常に効果的な即効性の漂白剤です。刺激臭のある黄緑色のガスです。
| IUPAC名 | 二酸化塩素 |
| 分子式 | ClO2 |
| CAS番号 | 10049-04-4 |
| 同義語 | 過酸化塩素、ClO2、酸化塩素(IV) |
| インチチ | InChI=1S/ClO2/c2-1-3 |
二酸化塩素配合
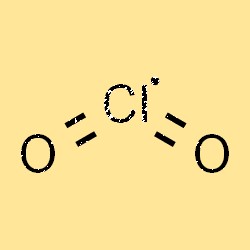
二酸化塩素の式はClO2です。 1 つの塩素原子と 2 つの酸素原子で構成される反応性の高いガスです。二酸化塩素の式はその分子構造を反映しており、これはその反応性、安定性、溶解性などの物理的および化学的特性を理解するために重要です。
ClO2 モル質量
ClO2 のモル質量は 67.45 g/mol です。これは非常に反応性の高い酸化剤であり、強力な美白特性で知られています。 ClO2 は、水処理、紙の漂白、食品の保存など、さまざまな産業および家庭用用途で消毒剤および消毒剤として広く使用されています。物質のモル質量は、密度、沸点、溶解度などの物理的および化学的特性を決定する上で重要な役割を果たします。
ClO2の沸点
ClO2 の沸点は 11.3°C (52.3°F) です。 ClO2 は標準の温度および圧力で黄緑色のガスとして存在します。刺激臭があり、反応性が高く、優れた酸化剤です。物質の沸点は、その安定性、揮発性、輸送性を決定するのに役立つ重要な物理的特性です。
ClO2 融点
ClO2 の融点は -51.5°C (-60.7°F) です。標準温度および常圧では気体であるため、固体状態ではありません。 ClO2 は水への溶解度が高く、水処理や食品保存用途で消毒剤や消毒剤として一般的に使用されています。物質の融点は、特に状態変化を伴う反応において、その物理的および化学的挙動に影響を与える可能性がある重要な特性です。
ClO2 密度 g/ml
ClO2 の密度は、標準温度および圧力で 1.97 g/mL です。これは反応性の高いガスで、さまざまな産業用途で漂白剤や消毒剤として一般的に使用されています。物質の密度は、輸送、保管、取り扱いなどのさまざまなプロセスにおける物質の挙動に影響を与える可能性がある重要な物理的特性です。
ClO2 分子量
ClO2 の分子量は 67.45 g/mol です。これは、水処理、紙の漂白、食品保存の用途に広く使用されている酸化剤です。物質の分子量は、密度、沸点、溶解度などの物理的および化学的挙動に影響を与える重要な特性です。
ClO2の構造
ClO2 の構造は分子式 ClO2 で表されます。 1 つの塩素原子と 2 つの酸素原子で構成される反応性の高いガスです。この分子は曲がった形状をしており、本質的に極性を持っています。つまり、プラスの端とマイナスの端があることを意味します。 ClO2 の構造は、その化学反応性、安定性、さまざまな溶媒への溶解度において重要な役割を果たします。
| 外観 | 黄緑色のガス |
| 比重 | 1.97g/ml |
| 色 | 黄緑色 |
| 匂い | エーカー |
| モル質量 | 67.45g/モル |
| 密度 | 1.97g/ml |
| 融合点 | -51.5°C (-60.7°F) |
| 沸点 | 11.3°C (52.3°F) |
| フラッシュドット | 該当なし(ガス) |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水や有機溶剤に溶ける |
| 蒸気圧 | 不特定 |
| 蒸気密度 | 不特定 |
| pKa | 不特定 |
| pH | 不特定 |
注: リストされている値の一部は、入手可能なデータに基づく推定値です。物質の特性に関する具体的かつ正確な情報については、信頼できる情報源を参照することが常に最善です。
二酸化塩素の安全性と危険性
ClO2 は反応性が高く有毒な物質であり、正しく取り扱わないと健康と安全に重大なリスクを引き起こす可能性があります。高濃度の ClO2 ガスにさらされると、目、鼻、喉の炎症、呼吸器疾患や呼吸困難を引き起こす可能性があります。 ClO2 を摂取すると、吐き気、嘔吐、下痢などの重篤な消化器疾患を引き起こす可能性があります。 ClO2 と皮膚が接触すると、炎症や化学火傷を引き起こす可能性があります。さらに、ClO2 は可燃性であり、熱や火花が存在すると発火する可能性があります。 ClO2 に関連するリスクを最小限に抑えるには、ClO2 を取り扱うときに手袋、ゴーグル、呼吸用保護具などの適切な個人用保護具を使用することが重要です。環境への ClO2 の放出を避けるために、安全な保管および取り扱い方法に従うことも重要です。
| ハザードシンボル | 酸化剤、有毒 |
| セキュリティの説明 | S2- 子供の手の届かないところに保管してください。 S22-粉塵を吸い込まないでください。 S26- 目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。 |
| AN識別子 | 国連 1479 |
| HSコード | 2828.90.90 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅲ |
| 毒性 | 二酸化塩素は、吸入、摂取、または皮膚と接触すると非常に有毒です。これにより、呼吸困難、消化困難、目の炎症、化学火傷を引き起こす可能性があります。 |
二酸化塩素の合成法
ClO2 は一般に、塩素酸塩-亜塩素酸塩法と電気分解法という 2 つの主な方法で合成されます。
塩素酸-亜塩素酸プロセスには、塩素酸ナトリウムと硫酸などの酸との反応が含まれ、ClO2 が生成されます。このプロセスは工業規模で実行でき、水処理やその他の用途のための ClO2 の製造に一般的に使用されます。
電気分解プロセスでは、電流を使用して ClO2 を生成します。このプロセスは通常実験室で行われ、研究や実験用に少量の ClO2 を生成するために使用されます。
使用する合成方法に関係なく、ClO2 を取り扱うときは、適切な安全プロトコルに従い、適切な保護具を使用することが重要です。これには、有毒ガスへの曝露を避けるための手袋、保護眼鏡、マスクの着用が含まれます。
これらの方法に加えて、亜塩素酸ナトリウムと酸の反応、または塩素酸ナトリウムと塩酸の反応によって二酸化塩素を生成することもできます。合成方法の選択は、特定の用途と最終製品の望ましい特性によって異なります。
二酸化塩素の使用
二酸化塩素は、水処理、食品保存、漂白など幅広い用途を持つ多用途の化学物質です。二酸化塩素の最も一般的な用途には次のようなものがあります。
水処理用の二酸化塩素は、飲料水、廃水、工業用プロセス水の処理における消毒剤として一般的に使用されます。細菌、ウイルス、寄生虫などの幅広い病原体に対して非常に有効であり、塩素やオゾンの代替品としてよく使用されます。
食品保存用二酸化塩素は、果物、野菜、肉、その他の食品の保存に抗菌剤として使用されます。細菌、酵母、カビなどのさまざまな微生物に対して効果があり、食品の保存期間を延長するのに役立ちます。
二酸化塩素は、木材パルプやその他の繊維を漂白して、明るく均一な色を生成するために使用されます。また、不純物を除去して白色度を向上させるために、綿やウールなどの繊維の漂白にも使用されます。
その他の用途 二酸化塩素は、産業廃棄物や都市廃棄物の処理、塩素酸塩、クロラミン、その他の消毒剤などの他の化学物質の製造にも使用されます。二酸化塩素はあらゆる用途において非常に効果的であり、他の化学処理に比べて多くの利点をもたらします。ただし、二酸化塩素は反応性が高く有毒な物質であり、正しく取り扱わないと健康と安全に重大なリスクをもたらす可能性があるため、取り扱いや使用には注意が必要です。
