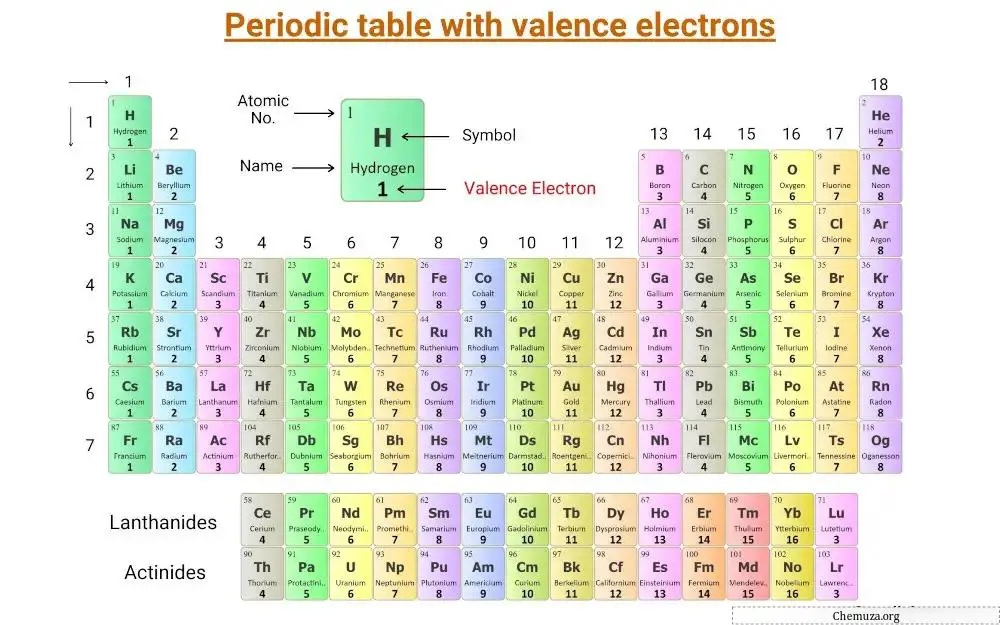
これは価電子が標識された周期表です。
価電子の概念を、主族元素と遷移元素の価電子の数とともに理解しましょう。
価電子とは何ですか?
価電子は、化学結合に関与する原子の最外殻またはエネルギー準位に位置する電子です。
たとえば、マグネシウムはその最外周軌道に 2 つの電子を持っているため、2 つの価電子を持っています。 [1]
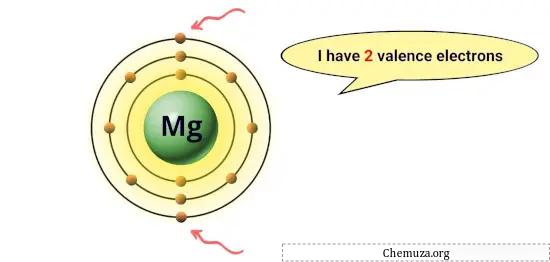
これらの電子は、元素の反応性や他の原子と形成できる化学結合の種類など、元素の化学的特性に関与します。
原子が持つ価電子の数によって、周期表におけるその位置と化学結合を形成する能力が決まります。
主族元素の価電子
主要元素は代表元素とも呼ばれ、周期表の第 1、2、および 13 から 18 族に位置します。
これらの元素の価電子の数は、そのグループの数と同じです。
たとえば、リチウムやナトリウムなどの第 1 族元素は 1 つの価電子を持ち、マグネシウムやカルシウムなどの第 2 族元素は 2 つの価電子を持ちます。
ホウ素やアルミニウムなどの 13 族元素は 3 つの価電子を持ちます。
これらの価電子は、元素の固有の化学的特性と反応性を決定します。
遷移元素と内部遷移元素の価電子
遷移元素および内部遷移元素の価電子は、主族元素の価電子よりも決定するのが複雑です。
実際、遷移要素のサブレイヤーd と内部遷移要素のサブレイヤー f は不完全に充填されており、外部サブレイヤー s に非常に近くなっています。
その結果、遷移元素の d および s サブシェルの電子と、内部遷移元素の f および s サブシェルの電子は、価電子のように振る舞うことができます。
遷移元素の場合、d サブシェル電子と s サブシェル電子の寄与により、価電子は 3 ~ 12 の範囲になります。場合によっては、不完全な d 軌道の電子も価電子と見なされます。 [2]
同様に、内部遷移元素 (または f ブロック元素) の場合、f サブシェル電子と s サブシェル電子の寄与により、価電子は 3 ~ 16 の範囲になります。 [3] 不完全な d 軌道の電子は、一部の内部遷移金属の価電子とみなすこともできます。
遷移元素および内部遷移元素の場合、価電子は希ガスコアの外側のシェルに存在する電子であることに注意することが重要です。
