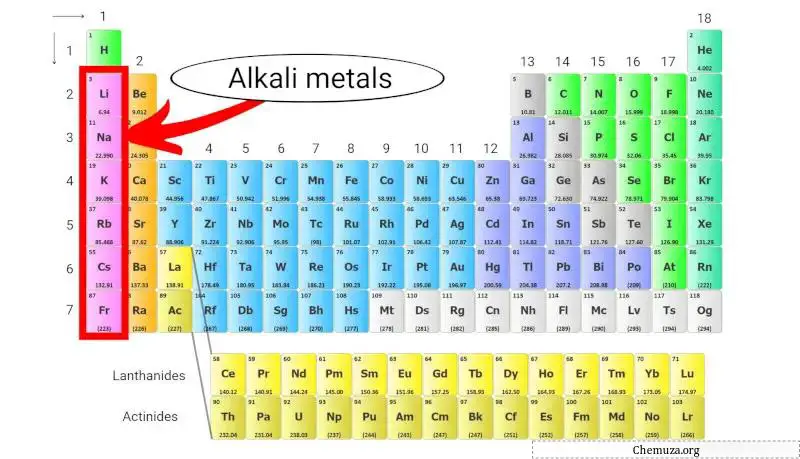
アルカリ金属は、周期表の最初の列に位置する化学元素のグループです。このグループには、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、フランシウムが含まれます。
アルカリ金属は柔らかく、融点と沸点が低いです。これらは電池、合金、さまざまな化学反応によく使用されます。
周期表上のアルカリ金属について詳しく見てみましょう。
アルカリ金属とは何ですか?

アルカリ金属は、周期表の第 1 族に属する化学元素のグループです。
これらの元素は、柔らかさ、融点が低く、反応性が高く、水と反応するとアルカリ溶液を形成する能力で知られています。
アルカリ金属の主な特性には次のようなものがあります。
- これらは電気陰性度およびイオン化エネルギーが低いため、電子を失いやすく、カチオンを形成する傾向があります。
- 融点と沸点が低いため、比較的柔らかく、溶けやすいです。
- 水や酸素との反応性が高く、空気中でも水中でも反応します。
- それらは熱と電気の良い伝導体です。
アルカリ金属はなぜそのように呼ばれるのでしょうか?

アルカリ金属は、水と反応すると強アルカリ性(塩基性)溶液を形成することができるため、このように呼ばれます。 [1]
これらの金属が水と接触すると、水素ガスを放出して水酸化物イオンを形成し、溶液に塩基性 pHを与えます。
説明:
アルカリ金属と水の反応性は、イオン化エネルギーが低いためです[2] 。これは、アルカリ金属が容易に電子を失い、陽イオン (カチオン) を形成する可能性があることを意味します。
水と接触すると、電子を失い、水分子と反応して水酸化物イオンと水素ガスを形成する化学反応が起こります。
この反応では多量の熱が放出され、水素ガスが発火して爆発する可能性があります。
アルカリ金属の反応性の順序
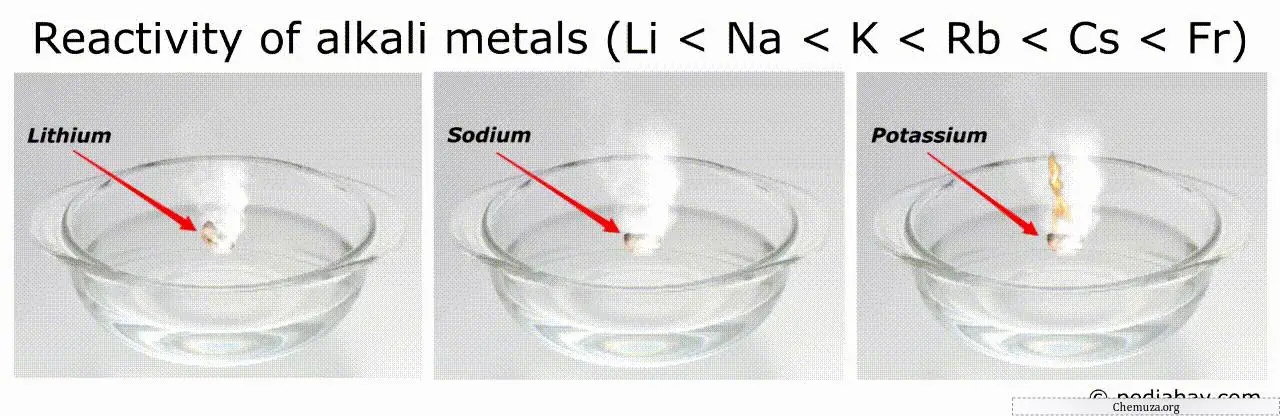
アルカリ金属の反応性の順序における一般的な傾向は、リチウム (Li) からフランシウム (Fr) まで下位グループに進むにつれて反応性が増加することです。
これは、フランシウムがすべてのアルカリ金属の中で最も反応性が高く、リチウムが最も反応性が低いことを意味します。
この傾向の理由は、グループの下に行くにつれて、元素の原子半径が増加し、イオン化エネルギーが減少するためです。
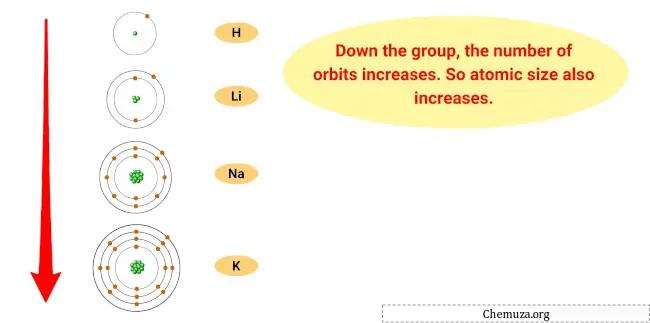
これは、原子の最も外側の電子が原子核から遠く離れており、保持力が弱くなっているため、元素がその電子を失いやすくなり、陽イオンになりやすいことを意味します。
フランシウムはグループの中で最大で最も近縁ではないため、最も反応的です。
この反応性の順序は、アルカリ金属の特性と挙動に重要な影響を及ぼします。
たとえば、最も反応性の高い金属 (フランシウムやセシウムなど) は空気中または水中で自然発火する可能性があり、取り扱うのが非常に危険です。[3]
逆に、反応性の低い金属 (リチウムなど) はより安定しており、より安定した金属を必要とする用途に使用できます。
アルカリ金属とその電子配置のリスト
アルカリ金属とその電子配置を以下に示します。
| 要素 | 電子構成 |
| リチウム(Li) | [それ] 2秒1 |
| ナトリウム(Na) | [実行] 3 秒1 |
| カリウム(K) | [Ar] 4秒1 |
| ルビジウム (Rb) | [Kr] 5秒1 |
| セシウム (Cs) | [Xe] 6秒1 |
| フランシウム (Fr) | [Rn] 7秒1 |
アルカリ金属の周期的傾向
アルカリ金属の周期的な傾向は次のとおりです。
- 価数の傾向:アルカリ金属の価数は常に +1 であり、安定したカチオンを形成するために電子を失う傾向があることを意味します。したがって、アルカリ金属の価数は、グループの下に移動しても変化しません。それらはすべて同じ価数 (つまり 1) を持ちます。
- 原子サイズの傾向:アルカリ金属の原子サイズは、グループが下になるほど大きくなり、原子が大きくなります。これは、エネルギー準位を追加すると、電子雲のサイズが増加するためです。
- 金属的性質の傾向:アルカリ金属の金属的性質は、グループが下になるほど増加します。これは、金属がより陽性になり、電子を供与して金属結合を形成できるようになるためです。
- 電気陰性度の傾向:アルカリ金属の電気陰性度は、グループが下になるほど減少します。これは、原子が大きくなり、外側の電子が原子核から遠く離れたため、原子核に引き寄せられにくくなるからです。
- 電子親和力の傾向:アルカリ金属の電子親和力は、グループが下になるほど減少します。実際、グループの最下位では原子のサイズが大きくなり、原子が電子を受け取る傾向が減少します。 (電子親和力の傾向について詳しくは、こちらをお読みください)。
- イオン化エネルギーの傾向:アルカリ金属のイオン化エネルギーは、グループが下になるほど減少します。これは、電子は原子核から遠く離れており、あまりしっかりと保持されていないため、原子の最外殻から電子を取り除くのが簡単であることを意味します。
まとめ
アルカリ金属は、柔らかさ、融点が低く、反応性が高く、水と反応するとアルカリ溶液を形成する能力で知られる化学元素のグループです。
アルカリ金属の反応性の次数は、原子半径の増加とイオン化エネルギーの減少により、リチウムからフランシウムまで族が下がるにつれて増加します。
アルカリ金属の周期的な傾向には、下位グループに進むにつれて原子サイズと金属的性質が増大すること、ならびに電気陰性度、電子親和力、およびイオン化エネルギーが減少することが含まれます。
アルカリ金属の価数は常に +1 であり、その電子配置は [希ガス] ns 1モデルに従います。
