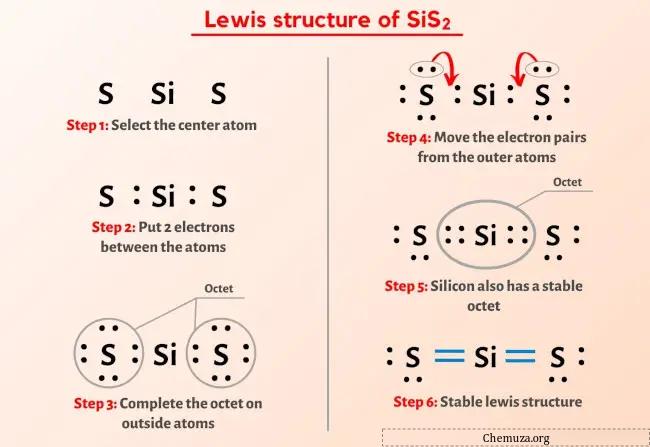
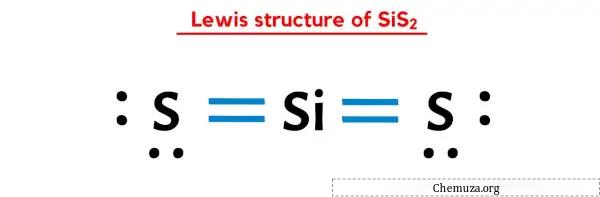
上の画像はもう見たはずですよね?
上の画像について簡単に説明します。
SiS2 ルイス構造は、中心にケイ素 (Si) 原子があり、その周りを 2 つの硫黄 (S) 原子が取り囲んでいます。ケイ素 (Si) 原子と各硫黄 (S) 原子の間には 2 つの二重結合があります。 2 つの硫黄 (S) 原子には 2 つの孤立電子対があります。
SiS2 (二硫化ケイ素) のルイス構造の上記の画像から何も理解できなかった場合は、 SiS2のルイス構造の描画方法についての詳細なステップバイステップの説明が表示されます。
それでは、SiS2 のルイス構造を描く手順に進みましょう。
SiS2 ルイス構造を描画する手順
ステップ 1: SiS2 分子内の価電子の総数を求める
SiS2 (二硫化ケイ素)分子内の価電子の総数を求めるには、まずケイ素原子と硫黄原子に存在する価電子を知る必要があります。
(価電子は、原子の最も外側の軌道に存在する電子です。)
ここでは、周期表を使用してシリコンと硫黄の価電子を簡単に見つける方法を説明します。
SiS2 分子内の総価電子
→ ケイ素原子によって与えられる価電子:
ケイ素は、周期表の第 14 族の元素です。 [1]したがって、シリコン中に存在する価電子は4です。
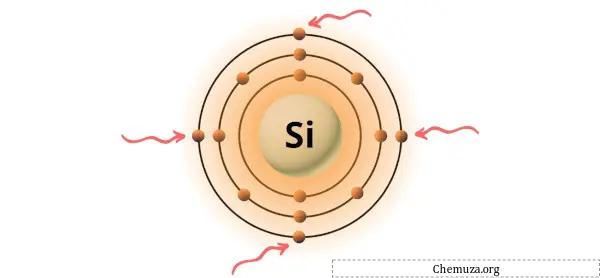
上の画像に示すように、シリコン原子には 4 つの価電子が存在することがわかります。
→ 硫黄原子によって与えられる価電子:
硫黄は、周期表の第 16 族の元素です。 [2]したがって、硫黄に存在する価電子は6です。
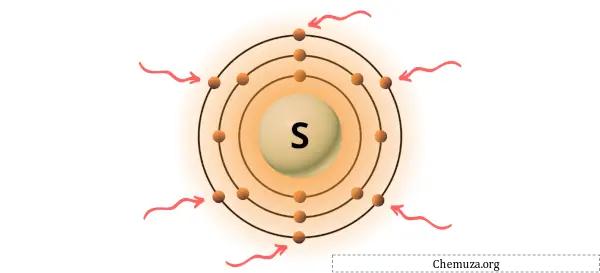
上の画像に示すように、硫黄原子には 6 つの価電子が存在することがわかります。
それで、
SiS2 分子内の総価電子= 1 つのシリコン原子によって供与される価電子 + 2 つの硫黄原子によって供与される価電子 = 4 + 6(2) = 16 。
ステップ 2: 中心原子を選択する
中心原子を選択するには、最も電気陰性度の低い原子が中心に残ることを覚えておく必要があります。
ここで、与えられた分子は SiS2 (二硫化ケイ素) であり、これにはケイ素 (Si) 原子と硫黄 (S) 原子が含まれています。
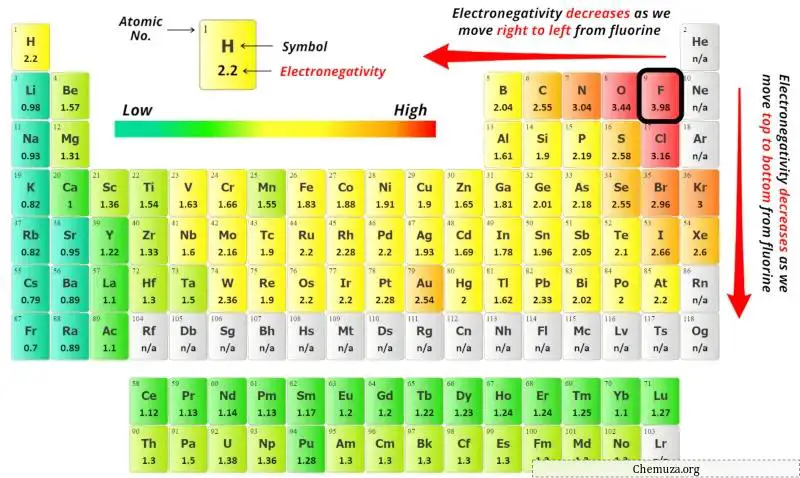
上記の周期表でケイ素(Si)原子と硫黄(S)原子の電気陰性度の値を確認できます。
シリコン(Si)と硫黄(S)の電気陰性度の値を比較すると、シリコン原子の方が電気陰性度が低くなります。
ここで、ケイ素 (Si) 原子が中心原子であり、硫黄 (S) 原子が外側の原子です。

ステップ 3: 各原子の間に電子対を配置して各原子を接続する
ここで、SiS2 分子では、シリコン原子 (Si) と硫黄原子 (S) の間に電子対を配置する必要があります。

これは、SiS2 分子内でケイ素 (Si) と硫黄 (S) が化学結合していることを示しています。
ステップ 4: 外部原子を安定化する
このステップでは、外部原子の安定性をチェックする必要があります。
ここの SiS2 分子の図では、外側の原子が硫黄原子であることがわかります。
これらの外部硫黄原子はオクテットを形成するため、安定しています。
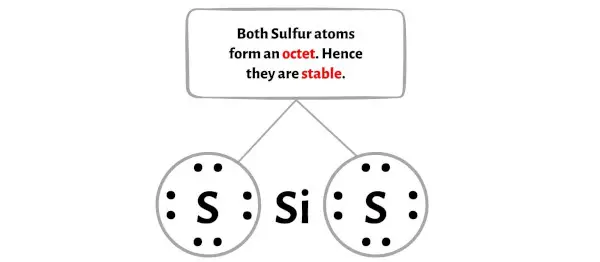
さらに、ステップ 1 では、SiS2 分子内に存在する価電子の総数を計算しました。
SiS2 分子には合計16 個の価電子があり、上の SiS2 の図ではこれらすべての価電子が使用されています。
したがって、中心原子上に保持すべき電子の対はもう存在しません。
それでは、次のステップに進みましょう。
ステップ 5: 中心原子のオクテットを確認します。オクテットがない場合は、非共有電子対を移動して二重結合または三重結合を形成します。
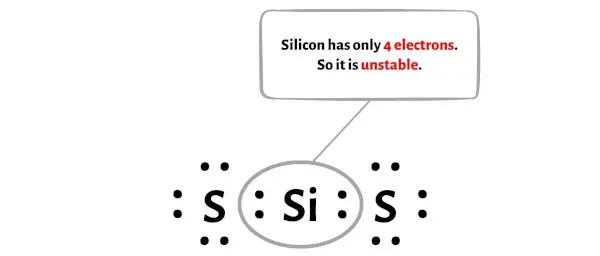
このステップでは、中心のシリコン (Si) 原子が安定であるかどうかを確認する必要があります。
中心のシリコン(Si)原子の安定性を確認するには、それがオクテットを形成しているかどうかを確認する必要があります。
残念ながら、シリコン原子はここではバイトを形成しません。シリコンは電子が4個しかなく不安定です。
ここで、このシリコン原子を安定させるには、シリコン原子が 8 個の電子 (つまり 1 オクテット) を持つことができるように、外側の硫黄原子の電子対を移動する必要があります。
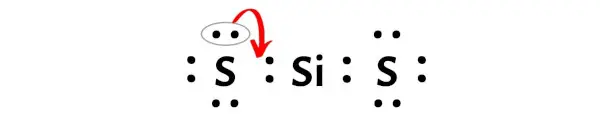
しかし、一対の電子を移動させた後でも、シリコン原子は電子を 6 個しか持たないため、依然としてオクテットを形成しません。
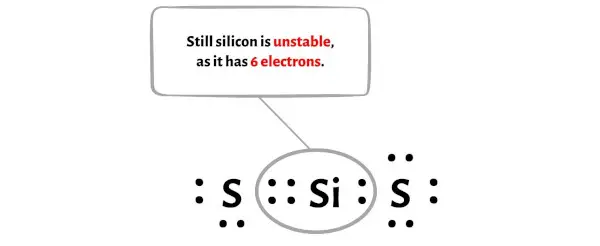
繰り返しますが、他の硫黄原子から追加の電子対を移動させる必要があります。

この一対の電子を移動させた後、中心のシリコン原子はさらに 2 個の電子を受け取り、その合計電子数は 8 個になります。
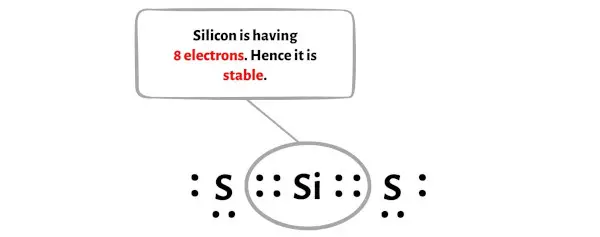
上の画像では、シリコン原子がバイトを形成していることがわかります。
したがって、ケイ素原子は安定です。
それでは、SiS2 のルイス構造が安定であるかどうかを確認する最後のステップに進みましょう。
ステップ 6: ルイス構造の安定性を確認する
これで、SiS2 のルイス構造の安定性を確認する必要がある最後のステップに到達しました。
ルイス構造の安定性は、形式電荷概念を使用して検証できます。
つまり、SiS2 分子に存在するシリコン (Si) 原子と硫黄 (S) 原子の形式電荷を見つける必要があります。
正式な税金を計算するには、次の式を使用する必要があります。
形式電荷 = 価電子 – (結合電子)/2 – 非結合電子
下の画像では、SiS2 分子の各原子の結合電子と非結合電子の数を確認できます。
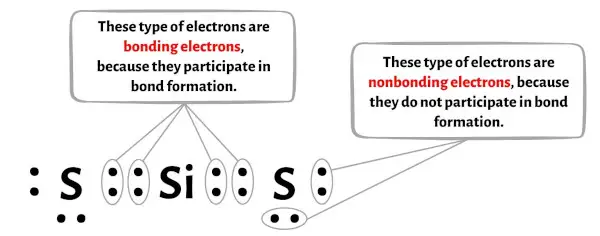
ケイ素原子 (Si) の場合:
価電子 = 4 (ケイ素は 14 族にあるため)
結合電子 = 8
非結合電子 = 0
硫黄 (S) 原子の場合:
価電子 = 6 (硫黄は 16 族にあるため)
結合電子 = 4
非結合電子 = 4
| 正式な告発 | = | 価電子 | – | (結合電子)/2 | – | 非結合電子 | ||
| イチイ | = | 4 | – | 8/2 | – | 0 | = | 0 |
| S | = | 6 | – | 4/2 | – | 4 | = | 0 |
上記の形式電荷の計算から、ケイ素 (Si) 原子と硫黄 (S) 原子の形式電荷が「ゼロ」であることがわかります。
これは、SiS2の上記ルイス構造が安定であり、上記SiS2の構造にさらなる変化がないことを示している。
上記の SiS2 のルイス ドット構造では、各結合電子対 (:) を単結合(|) として表すこともできます。そうすると、SiS2 は次のようなルイス構造になります。
上記の手順をすべて完全に理解していただければ幸いです。
さらに練習して理解を深めたい場合は、以下にリストされている他のルイス構造を試してみてください。
理解を深めるために、次のルイス構造を試してください (または少なくとも見てください)。
