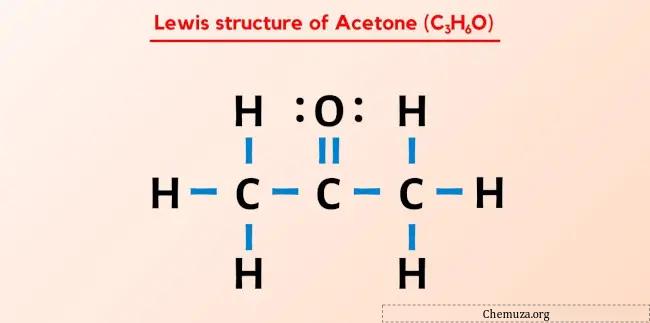
アセトン (プロパノンまたは C3H6O としても知られる) のルイス構造には、3 つの連続した炭素 (C) 原子があり、中心の炭素 (C) 原子に二重結合した酸素 (O) 原子と 3 つの単一の水素 (H) 原子が結合しています。外側の各炭素 (C) 原子に。酸素 (O) 原子上には 2 つの孤立電子対があります。
アセトン(C3H6O)のルイス構造を描く手順
ステップ 1: C3H6O 分子内の価電子の総数を見つける
C3H6O分子内の価電子の総数を求めるには、まず炭素原子、水素原子、酸素原子に存在する価電子を知る必要があります。
(価電子は、原子の最も外側の軌道に存在する電子です。)
ここでは周期表を使って炭素、水素、酸素の価電子を簡単に求める方法を説明します。
C3H6O 分子内の総価電子
→ 炭素原子によって与えられる価電子:
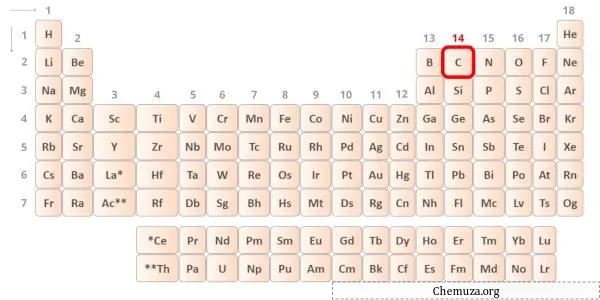
炭素は周期表の第 14 族の元素です。 [1]したがって、炭素に存在する価電子は4です。
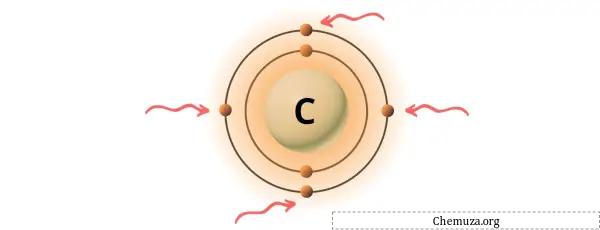
上の画像に示すように、炭素原子には 4 つの価電子が存在することがわかります。
→ 水素原子によって与えられる価電子:
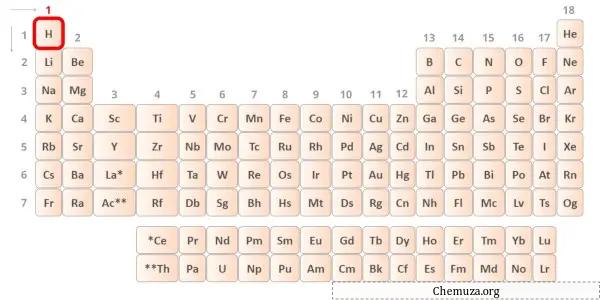
水素は周期表の第 1 族元素です。[2]したがって、水素に存在する価電子は1です。

上の図に示すように、水素原子には価電子が 1 つだけ存在していることがわかります。
→ 酸素原子によって与えられる価電子:

酸素は、周期表の第 16 族の元素です。 [3]したがって、酸素に存在する価電子は6です。
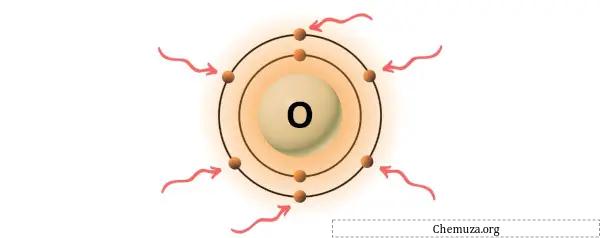
上の画像に示すように、酸素原子には 6 つの価電子が存在することがわかります。
それで、
C3H6O 分子内の総価電子= 3 個の炭素原子によって供与された価電子 + 6 個の水素原子によって供与された価電子 + 1 個の酸素原子によって供与された価電子 = 4(3) + 1(6) + 6 = 24 。
ステップ 2: スケッチを準備する
アセトンのルイス構造には、中央の炭素原子に酸素原子が結合した 3 つの連続した炭素原子があります。水素原子は外側の 2 つの炭素原子に結合しています。酸素原子は炭素原子に二重結合していますが、水素原子は炭素原子に単結合しています。
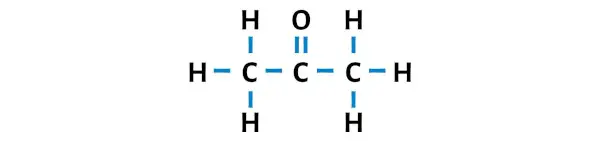
ステップ 3: 外部原子を安定にする
ここの C3H6O 分子のスケッチでは、外側の原子が水素原子と酸素原子であることがわかります。
水素原子は 2 つの電子を持っているため安定しています (水素は安定した二重項を形成するために 2 つの電子のみを必要とするため)。
それでは、酸素原子上にオクテットを形成して酸素原子を安定させましょう。
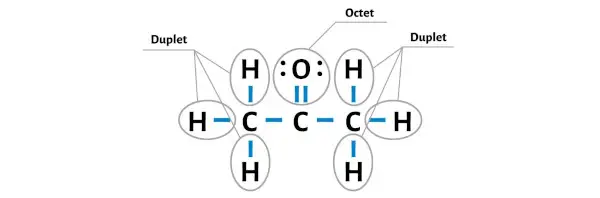
すべての外部原子が安定していることがわかります。
さらに、ステップ 1 では、C3H6O 分子内に存在する価電子の総数を計算しました。
C3H6O 分子には合計24 個の価電子があり、これらすべての価電子が上の C3H6O の図で使用されています。
したがって、上記の C3H6O (またはアセトン) のルイス構造は安定な構造です。
上記の手順を理解していただければ幸いです。
さらに練習して理解を深めたい場合は、以下にリストされている他のルイス構造を試してみてください。
理解を深めるために、次のルイス構造を試してください (または少なくとも見てください)。
