塩化亜鉛 (ZnCl2) は白色の結晶性化合物です。はんだ付け用フラックス、化学合成、亜鉛メッキなどのさまざまな産業用途に使用されています。水に非常に溶けやすいです。
| IUPAC名 | 塩化亜鉛 |
| 分子式 | ZnCl2 |
| CAS番号 | 7646-85-7 |
| 同義語 | 亜鉛バター;二塩化亜鉛;塩化亜鉛(II);亜鉛バター; CI77043 |
| インチチ | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
塩化亜鉛の性質
塩化亜鉛の配合
二塩化亜鉛の化学式は ZnCl2 です。 1 つの亜鉛原子 (Zn) と 2 つの塩素原子 (Cl) で構成されています。このイオン性化合物は、独特の構造を持つ白色の結晶性固体を形成します。
塩化亜鉛モル質量
二塩化亜鉛のモル質量は、約 136.29 グラム/モル (g/mol) です。これは、1 つの亜鉛原子と 2 つの塩素原子の原子量の合計から求められます。
塩化亜鉛の沸点
二塩化亜鉛は、摂氏約 732 度 (C) または華氏 1,350 度 (F) と比較的高い沸点を持っています。この温度では、液体から気体状態に変化します。
塩化亜鉛の融点
二塩化亜鉛の融点は約摂氏 290 度 (C) または華氏 554 度 (F) です。この温度では、固体の二塩化亜鉛が液体状態に変化します。
塩化亜鉛の密度 g/mL
二塩化亜鉛の密度は、室温で約 2.91 グラム/ミリリットル (g/mL) です。この特性は、単位体積あたりの質量を表します。
塩化亜鉛の分子量
二塩化亜鉛の分子量は、化学式から計算すると約 136.29 g/mol です。この値は、構成原子の原子量の合計を表します。
塩化亜鉛の構造
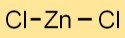
二塩化亜鉛は、Zn2+ カチオンとクラニオンがイオン結合で結合した結晶格子構造を持っています。この配置により、安定した秩序ある三次元ネットワークが形成されます。
塩化亜鉛の溶解度
二塩化亜鉛は水に非常に溶けやすく、水分子の存在下で容易に溶解します。この特性は、さまざまな産業用途や化学プロセスでの広範な使用に貢献します。
| 外観 | 白色の結晶固体 |
| 比重 | 2.91g/ml |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 136.29 g/モル |
| 密度 | 2.91 g/cm3 |
| 融合点 | 290°C (554°F) |
| 沸点 | 732°C (1350°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水に非常に溶けやすい |
| 溶解性 | アルコール、アセトンなどの有機溶剤に可溶 |
| 蒸気圧 | 359℃で1mmHg |
| 蒸気密度 | 5.4 (空気 = 1) |
| pKa | -1.9 |
| pH | ~5 (0.1 M 水溶液) |
塩化亜鉛の安全性と危険性
二塩化亜鉛には安全上のリスクがあり、慎重な取り扱いが必要です。皮膚や目に直接触れると、炎症や火傷を引き起こす可能性があります。その蒸気を吸入すると、呼吸器系を刺激する可能性があります。コンパウンドを取り扱う際は、手袋やゴーグルなどの保護具を着用することが不可欠です。さらに、不適合物質から離れた、換気の良い場所に保管する必要があります。摂取または誤って暴露した場合は、直ちに医師の診察を受けてください。水生生物に悪影響を与える可能性があるため、環境中に放出しないようにしてください。適切な安全対策とガイドラインに従うことで、二塩化亜鉛に関連するリスクを効果的に最小限に抑えることができます。
| ハザードシンボル | 腐食性 (C);有害 (Xn) |
| セキュリティの説明 | 皮膚や目との接触を避けてください。換気の良い場所で使用してください。手袋と保護メガネを着用してください。接触または摂取した場合は医師に相談してください。環境中に放出しないでください。混入しない物質から遠ざけてください。 |
| 国連識別番号 | 国連番号 2331 (無水二塩化亜鉛); UN No. 2332 (二塩化亜鉛、溶液) |
| HSコード | 28273990 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | II(中危険) |
| 毒性 | 飲み込んだり吸入すると有害です。 |
塩化亜鉛の合成方法
さまざまな方法で二塩化亜鉛を合成できます。
一般的なアプローチには、酸化亜鉛 (ZnO)と塩酸 (HCl)の反応が含まれます。この方法では、化学者が継続的に撹拌しながら、HCl 溶液に ZnO をゆっくりと加えます。この反応により、副生成物として二塩化亜鉛と水が生成されます。もう 1 つの方法は、亜鉛金属と塩素ガス (Cl2) を直接組み合わせる方法です。この反応を確実に成功させるには、温度と圧力を注意深く制御する必要があります。
別のプロセスでは、金属亜鉛を HCl 溶液に溶解し、二塩化亜鉛と水素ガス (H2) が生成されます。 HCl を炭酸亜鉛 (ZnCO3) または水酸化亜鉛 (Zn(OH)2) で処理すると、副生成物として二塩化亜鉛、水、二酸化炭素 (CO2) が生成されます。
硫酸亜鉛 (ZnSO4)と塩化バリウム (BaCl2) は二重分解反応を起こし、二塩化亜鉛を生成するだけでなく、硫酸バリウム (BaSO4) も生成します。これら 2 つの化合物を混合すると、二塩化亜鉛が沈殿しますが、硫酸バリウム (BaSO4) は溶液中に残ります。
これらの各方法は二塩化亜鉛の合成経路を提供し、方法の選択は試薬の入手可能性、反応条件、最終生成物の望ましい純度などの要因によって異なります。
塩化亜鉛の用途
二塩化亜鉛は、その多用途な特性により、さまざまな産業で幅広い用途が見出されます。二塩化亜鉛の重要な用途をいくつか紹介します。
- 亜鉛メッキ: 二塩化亜鉛は、鋼や鉄などの金属の腐食を防ぐために亜鉛メッキプロセスで重要な役割を果たします。亜鉛の保護コーティングを形成し、寿命と耐久性が向上します。
- はんだ付け用フラックス:ろう付け作業において、二塩化亜鉛は金属表面から金属酸化物を除去するためのフラックスとして機能し、はんだと金属間の接着力を向上させ、強力な結合を実現します。
- 化学合成:アシル化やフリーデルクラフツ脱水など、多くの化学反応において触媒または試薬として機能します。
- 木材の保存:木材の保存剤アプリケーションでは、二塩化亜鉛を使用して木材を菌類の腐敗や昆虫から保護し、その寿命を延ばします。
- 繊維加工:繊維産業では、シルケット加工された綿生地の生産が容易になり、光沢の増加や強度の向上などの望ましい特性が付与されます。
- 電池電解液:二塩化亜鉛は、亜鉛炭素電池などの一部の電池で電解液として機能し、電極間のイオンの流れを促進します。
- デオドラントと制汗剤:収斂作用があり、発汗を抑え、体臭を抑えるのに役立つため、制汗剤の一般的な成分です。
- 医薬品:二塩化亜鉛は、さまざまな医薬製剤、特にうがい薬、のど飴、局所消毒液などに応用されています。
- 染色産業: 染色産業では、染料による布地の色堅牢度を向上させるために、染色プロセスの媒染剤として二塩化亜鉛を使用しています。
- 接着剤配合物:メーカーは、接着剤やセメントの接着特性を向上させるために、二塩化亜鉛を接着剤配合物に組み込んでいます。
二塩化亜鉛はその多用途性により、多くの工業プロセスや日用品に不可欠な化合物となっており、いくつかの主要産業の発展に貢献しています。
質問:
Q: ZnCl2 は水に溶けますか?
A: はい、ZnCl2 は水によく溶けます。
Q: ZnCl2 と NaOH の反応の正味のイオン方程式は何ですか?
A: 正味のイオン方程式は Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s) です。
Q: ZnCl2 は可溶ですか?
A: はい、ZnCl2 は水に溶けます。
Q: ZnCl2 はイオン性ですか、それとも分子性ですか?
A: ZnCl2 はイオン性化合物です。
Q: 塩化亜鉛(II)、ZnCl2 ではどのような種類の結合が発生しますか?
A: ZnCl2 ではイオン結合が生じます。
Q: どのような変化が ZnCl2 生成速度を低下させる可能性がありますか?
A: 反応温度を下げると、ZnCl2 の生成速度が低下する可能性があります。
Q: ZnCl2 は固体ですか?
A: はい、ZnCl2 は室温では固体です。
Q: ZnCl2 は塩ですか?
A: はい、ZnCl2 は塩とみなされます。
Q: 亜鉛から塩化亜鉛を得るにはどうすればよいですか?
A: 亜鉛と塩酸を反応させると塩化亜鉛が生成されます。
Q: 塩化亜鉛の式は何ですか?
A: 塩化亜鉛の式は ZnCl2 です。
Q: 塩化亜鉛電池は地球に有害ですか?
A: はい、塩化亜鉛電池は適切に廃棄しないと環境に有害となる可能性があります。
Q: 塩化亜鉛のモル質量はどれくらいですか?
A: 塩化亜鉛のモル質量は約 136.29 g/mol です。
