四塩化炭素は、甘い香りを持つ無色の液体です。これは溶剤として一般的に使用されていましたが、健康と環境に悪影響を与えるため、その生産と使用は減少しました。
| IUPAC名 | テトラクロロメタン |
| 分子式 | CCl4 |
| CAS番号 | 56-23-5 |
| 同義語 | カーボンテット、テトラホルム、パークロロメタン、テトラソール |
| インチチ | InChI=1S/CCl4/c2-1(3,4)5 |
四塩化炭素の性質
四塩化炭素の式
四塩化炭素の化学式は CCl4 です。これは、4 つの塩素原子に結合した炭素原子で構成される分子を表します。この式は、元素組成と化合物内の原子の配置に関する重要な情報を提供します。
四塩化炭素モル質量
テトラクロロメタンのモル質量は、その構成要素の原子質量を加算することによって計算されます。炭素のモル質量は 12.01 g/mol ですが、塩素のモル質量は 35.45 g/mol です。これらの値を合計すると、テトラクロロメタンのモル質量は約 153.82 g/mol になります。
四塩化炭素の沸点
テトラクロロメタンの沸点は 76.72°C (170.1°F) と比較的高くなります。これは、標準大気圧では、その温度で化合物が液体から気体に変化することを意味します。沸点は、物質内の分子間力の強さを反映します。
四塩化炭素 融点
テトラクロロメタンの融点は -22.92°C (-9.26°F) です。これは、化合物の固体が液体に変わる温度です。融点は、結晶格子内で原子を結合する結合の強さについての洞察を提供します。
四塩化炭素の密度 g/mL
テトラクロロメタンの密度は約 1.586 g/mL です。密度とは、単位体積あたりの物質の質量を指します。テトラクロロメタンの密度は、密度が 1 g/mL である水よりも密度が高いことを示します。
四塩化炭素の分子量
テトラクロロメタンの分子量は、構成原子の原子量を加算して計算されます。 1 つの炭素原子 (12.01 g/mol) と 4 つの塩素原子 (それぞれ 35.45 g/mol) を含むテトラクロロメタンの分子量は約 153.82 g/mol です。
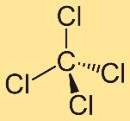
四塩化炭素の構造
テトラクロロメタンの構造は、4 つの塩素原子に結合した中心の炭素原子で構成されています。これらの塩素原子は炭素原子の周りに対称的に配置され、四面体形状を形成します。この構造は、化合物の特性と挙動に寄与します。
四塩化炭素の溶解度
テトラクロロメタンは水に溶けにくく、20℃での溶解度は約 0.8 g/L です。ただし、エタノール、エーテル、ベンゼンなどの有機溶媒に対してはより高い溶解性を示します。溶解度の特性は、分子間力と関係する物質の極性に影響されます。
| 外観 | 無色の液体 |
| 比重 | 1,586 |
| 色 | 該当なし |
| 匂い | 柔らかい |
| モル質量 | 153.82 g/モル |
| 密度 | 1,586g/mL |
| 融合点 | -22.92°C (-9.26°F) |
| 沸点 | 76.72℃ (170.1°F) |
| フラッシュドット | 該当なし |
| 水への溶解度 | 0.8g/L(20℃) |
| 溶解性 | エタノール、エーテル、ベンゼンなどの有機溶媒に可溶 |
| 蒸気圧 | 11.9 mmHg(20℃) |
| 蒸気密度 | 5.3 (空気 = 1) |
| pKa | 該当なし |
| pH | 該当なし |
四塩化炭素の安全性と危険性
テトラクロロメタンは重大な安全上のリスクをもたらします。それは非常に有毒であると考えられており、人間の健康に重大な害を及ぼす可能性があります。その蒸気を吸入すると、呼吸器への刺激、めまい、吐き気、さらには肝臓や腎臓の損傷を引き起こす可能性があります。液体が皮膚に接触すると、火傷や炎症を引き起こす可能性があります。この化合物は発がん性物質としても知られており、長期的な健康リスクをもたらします。さらに、テトラクロロメタンは環境に有害であり、土壌や水を汚染する可能性があります。これらの危険性のため、暴露を最小限に抑え、人間の健康と環境の両方を保護するために、その生産と使用は大幅に制限されています。テトラクロロメタンに関連するリスクを軽減するには、適切な取り扱い、保管、廃棄手順に従う必要があります。
| ハザードシンボル | T、Xn |
| セキュリティの説明 | 非常に有毒です。有害 |
| 国連識別番号 | 1846年 |
| HSコード | 2903.14.0000 |
| 危険等級 | 6.1 (有毒物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 急性毒性、発がん性 |
四塩化炭素の合成方法
テトラクロロメタンはさまざまな方法で合成できます。一般的な方法には、塩化アルミニウム (AlCl3) などの触媒の存在下での塩素ガス (Cl2)と二硫化炭素 (CS2) の反応が含まれます。
このプロセスでは、塩素ガスが二硫化炭素蒸気と反応して、テトラクロロメタンと硫黄が生成されます。反応は次のように進行します。
Cl2 + CS2 → CCl4 + S
別の方法には、メタン (CH4)と塩素ガスの反応が含まれます。制御された条件下で、紫外線 (UV) 光または熱の存在下でメタンが塩素と反応して、テトラクロロメタンと塩化水素が生成されます。反応は次のように進行します。
CH4 + 4Cl2 → CCl4 + 4HCl
塩素化剤として塩化水素 (HCl) を使用して二硫化炭素を塩素化すると、テトラクロロメタンが生成されます。この反応には、塩化鉄(III) (FeCl3) などの触媒が必要です。反応は次のように進行します。
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
テトラクロロメタンを合成する場合、化合物の危険な性質のため注意を払う必要があります。健康を確保し、環境汚染を防ぐために、厳格な安全対策と適切な設備を使用する必要があります。
四塩化炭素の用途
テトラクロロメタンのユニークな特性はさまざまな用途に利用されています。その用途の一部を次に示します。
- 溶剤:テトラクロロメタンは油、グリース、ゴム、ワックスを溶解し、溶剤として機能します。しかし、その毒性と環境への懸念により、溶剤の使用は大幅に減少しました。
- 消火器: テトラクロロメタンは、電気機器や可燃性液体が関係する特定の種類の火災を消すために使用されます。より安全な代替品とその有害な影響により、その使用は徐々に放棄されています。
- 化学中間体: テトラクロロメタンは、冷媒、殺虫剤、医薬品などのさまざまな化合物の製造における化学中間体として機能してきました。
- 洗浄剤: 業界では以前、金属表面や電子部品の洗浄剤としてテトラクロロメタンを使用していました。しかし、健康と環境のリスクにより、より安全な代替品が好まれるようになりました。
- 実験室試薬: テトラクロロメタンは、実験室での特定の反応や抽出のための試薬または溶媒として使用されることがあります。化学者は一般に、より安全な代替品を好み、その使用を制限します。
テトラクロロメタンが人間の健康や環境に悪影響を与えるため、これらの用途の多くは減少、さらには完全に中止されていることに注意することが重要です。その結果、テトラクロロメタンの使用は大幅に減少し、毒性や環境への影響が少ない代替物質がさまざまな業界で採用されています。
質問:
Q: 四塩化炭素の代替品はまだ購入できますか?
A: はい、より安全で環境への影響が少ないテトラクロロメタンの代替品があります。
Q: 四塩化炭素はまだ購入できますか?
A: テトラクロロメタンは、その毒性と環境リスクにより多くの国で制限されているため、購入できる量は限られています。
Q: 四塩化炭素は合法ですか?
A: テトラクロロメタンは、健康や環境に悪影響を与えるため、多くの国で法的規制の対象となっています。
Q: 四塩化炭素はアルカリ性ですか、酸性ですか?
A: テトラクロロメタンはアルカリ性でも酸性でもありません。それは中性の化合物です。
Q: 四塩化炭素は極性ですか、それとも無極性ですか?
A: テトラクロロメタンは、その対称四面体構造により無極性分子であり、その結果、電子が均等に共有されます。
Q: 四塩化炭素のモル質量はどれくらいですか?
A: テトラクロロメタンのモル質量は約 153.82 g/mol です。
Q: 四塩化炭素とは何ですか?
A: テトラクロロメタンは無色の液体化合物で、かつては主に溶剤として使用されていましたが、毒性と環境への懸念から現在ではその使用が制限されています。
Q: 四塩化炭素の化学式は何ですか?
A: テトラクロロメタンの化学式は CCl4 です。
Q: 結合は四塩化炭素ですか?
A: テトラクロロメタンの結合は共有結合であり、中心の炭素原子と周囲の塩素原子の間に 4 つの共有結合があります。
Q: 四塩化炭素はイオン性ですか、それとも共有結合性ですか?
A: テトラクロロメタンは、炭素原子と塩素原子の間で電子を共有することによって結合を形成するため、共有結合性化合物です。
Q: 四塩化炭素分子には塩素原子が何個ありますか?
A: テトラクロロメタンの分子には 4 つの塩素原子があります。
Q: 各溶質について、最適な溶媒を特定してください: 水ですか、それとも四塩化炭素ですか?
A: 最適な溶媒は溶質によって異なります。一般に極性物質には水の方が適していますが、非極性物質にはテトラクロロメタンの方が適しています。
Q: テトラクロロメタンのルイス構造は何ですか?
A: テトラクロロメタンのルイス構造では、中心の炭素原子が 4 つの塩素原子に結合しており、中心の炭素原子には非共有電子対がありません。
