水酸化ニッケル (Ni(OH)2) は、ニッケルと水酸化物イオンから構成される化合物です。ニッケルベースの電池の前駆体としてよく使用されます。
| IUPACの名称 | 水酸化ニッケル |
| 分子式 | Ni(OH)2 |
| CAS番号 | 12054-48-7 |
| 同義語 | 水酸化ニッケル(II);水酸化ニッケル;窒素 三酸化ニッケル (2+) |
| インチチ | InChI=1S/Ni・2H2O/h;2*1H2/q+2;;/p-2 |
水酸化ニッケルの性質
水酸化ニッケルの配合
水酸化ニッケルの化学式は Ni(OH)2 です。 1 つのニッケルイオン (Ni) と 2 つの水酸化物イオン (OH-) から構成されます。この化学式は、水酸化ニッケルの組成を原子レベルで表しています。
水酸化ニッケルのモル質量
Ni(OH)2 のモル質量は、構成元素の原子質量を加算することによって計算されます。ニッケルの原子質量は 58.6934 g/mol、各水酸化物イオンの質量は 17.007 g/mol です。それらを合計すると、Ni(OH)2 のモル質量は約 92.6934 g/mol になります。
水酸化ニッケルの沸点
Ni(OH)2 は加熱すると分解するため、明確に定義された沸点がありません。高温になると熱分解が起こり、酸化ニッケル(NiO)と水蒸気に変化します。
水酸化ニッケルの融点
Ni(OH)2 の融点は約 230°C です。この温度では、Ni(OH)2 は固体状態から液体状態に相変化します。化合物が溶けて、さらなる化学反応や処理が可能になります。
水酸化ニッケルの密度 g/mL
Ni(OH)2 の密度は約 4.1 g/mL です。この値は、単位体積あたりの化合物の質量を表します。これは、特定の空間における Ni(OH)2 の緻密さまたは濃度を示します。
水酸化ニッケルの分子量
Ni(OH)2 の分子量は、構成元素の原子量を加算することによって決定されます。ニッケルの原子量は 58.6934 g/mol、各水酸化物イオンの重量は 17.007 g/mol です。したがって、Ni(OH)2 の分子量は約 92.6934 g/mol です。
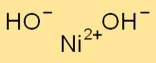
水酸化ニッケルの構造
Ni(OH)2 は六方晶系で結晶化します。これは、互いに積み重ねられた Ni+2 イオンと OH- イオンの層を形成します。 Ni+2イオンはOH-イオンに取り囲まれ、ネットワーク構造を形成しています。
水酸化ニッケルの溶解度
Ni(OH)2 は水に溶けにくいです。ある程度溶解し、水酸化物イオンの存在により弱アルカリ性溶液を形成します。 Ni(OH)2 の溶解度は、温度や pH などの要因に影響される可能性があります。
| 外観 | 緑色に点灯 |
| 比重 | 4.1g/ml |
| 色 | 緑 |
| 匂い | 無臭 |
| モル質量 | 92.6934 g/モル |
| 密度 | 4.1g/ml |
| 融合点 | 230℃ |
| 沸点 | 分解された |
| フラッシュドット | 該当なし |
| 水への溶解度 | わずかに溶ける |
| 溶解性 | 不溶性、水中でアルカリ溶液を形成する |
| 蒸気圧 | 該当なし |
| 蒸気密度 | 該当なし |
| pKa | 該当なし |
| pH | アルカリ性 |
水酸化ニッケルの安全性と危険性
Ni(OH)2 は、考慮する必要がある特定の安全上のリスクをもたらします。接触または吸入すると、皮膚、目、呼吸器系を刺激する可能性があります。長期間または繰り返し暴露すると、感作が起こり、アレルギー反応を引き起こす可能性があります。手袋、ゴーグル、マスクなどの適切な保護手段を使用して、Ni(OH)2 を慎重に取り扱うことが重要です。摂取または誤って暴露した場合は、直ちに医師の診察を受ける必要があります。さらに、Ni(OH)2 は環境危険物とみなされており、土壌や水源の汚染を防ぐために規制に従って適切に処分する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | – 皮膚や目の炎症を引き起こす可能性があります\n- 呼吸器への刺激を引き起こす可能性があります\n- 感作の可能性があります\n- 適切な取り扱いおよび廃棄手順に従ってください |
| 国連識別番号 | 適用できない |
| HSコード | 2825.70.10 |
| 危険等級 | 危険物として分類されていない |
| 梱包グループ | 適用できない |
| 毒性 | 低毒性から中程度の毒性と考えられています |
Ni(OH)2 は有害物質として分類されていないため、危険記号および国連識別子は適用されないことに注意してください。提供される安全性の説明では、Ni(OH)2 の取り扱いに関連する潜在的なリスクと注意事項が強調されています。 Ni(OH)2 の毒性は一般に低から中程度であると考えられています。
水酸化ニッケルの合成法
Ni(OH)2 の製造にはいくつかの合成方法が利用できます。一般的な方法には、硫酸ニッケルや硝酸ニッケルなどの可溶性ニッケル塩と、通常は水酸化ナトリウムや水酸化カリウムなどのアルカリ性水酸化物との反応が含まれます。反応は制御された条件下で水溶液中で起こり、沈殿物として Ni(OH)2 が形成されます。
電気化学堆積法では、電解槽は電極として金属ニッケルを使用します。適切な電流を流して電解液からニッケルイオンを還元し、Ni(OH)2 の形で電極上に堆積させます。この方法により、得られる Ni(OH)2 の組成と形態を正確に制御できます。
ニッケル塩の熱分解により、Ni(OH)2 が生成されます。炭酸ニッケルなどのニッケル塩や Ni(OH)2 自体を制御された環境で加熱すると、化合物が分解し、Ni(OH)2 やその他の副生成物が生成されます。
合成方法の選択は、目的の純度、粒子サイズ、特定の用途要件などの要因に依存することに言及する価値があります。 Ni(OH)2 生成に適切な合成経路を選択する場合、各方法に関連する利点と制限があるため、望ましい結果を慎重に考慮する必要があります。
水酸化ニッケルの用途
Ni(OH)2 は、そのユニークな特性によりさまざまな用途に使用されます。 Ni(OH)2 の一般的な用途をいくつか示します。
- 電池製造: Ni(OH)2 は、ニッケルカドミウム (NiCd) 電池やニッケル水素 (NiMH) 電池などのニッケルベース電池の正極材料として重要な役割を果たします。電気エネルギーを貯蔵および放出し、効率的なエネルギー貯蔵を可能にします。
- 触媒: Ni(OH)2 は、水素化や酸化プロセスを含むさまざまな化学反応において触媒として機能します。その触媒特性により、反応物質から目的の生成物への効率的な変換が促進されます。
- 電気めっき: Ni(OH)2 は安定した付着性のあるニッケル層を形成するため、電気めっき用途で価値があります。さまざまな金属表面に保護性、耐食性、美観に優れたコーティングを施します。
- 顔料: メーカーは、セラミック、ガラス、プラスチックの製造において、緑色の顔料として Ni(OH)2 を使用します。その鮮やかな緑色は、これらの素材の美的価値を高めます。
- ガスセンサー: Ni(OH)2 ベースのセンサーは、水素、アンモニア、硫化水素などのガスを検出および監視します。 Ni(OH)2 膜の電気伝導率の変化により、これらのガスを効率的に検出できるようになります。
- 水処理: Ni(OH)2 は、鉛やカドミウムなどの重金属汚染物質を選択的に吸着して除去することにより、水処理プロセスを支援します。これらの金属に対して親和性を示すため、水源からの金属の除去に役立ちます。
- 医薬用途: Ni(OH)2 は医薬製剤に応用され、錠剤やカプセル製剤の結合剤、崩壊剤、または pH 調整剤として機能します。
これらは Ni(OH)2 のさまざまな用途のほんの一例であり、さまざまな業界における Ni(OH)2 の多用途性と重要性を示しています。
質問:
Q: 塩基性水酸化ニッケル(II)の化学式は何ですか?
A: 水酸化ニッケル(II)の化学式はNi(OH)2です。
Q: 水酸化ニッケルは水に溶けますか?
A: Ni(OH)2 は水に溶けません。
Q: 0.555 M 水酸化リチウム 75.0 ml を中和するには、何グラムの塩化ニッケル (II) が必要ですか?
A: 必要な塩化ニッケルのグラム数は、水酸化リチウム溶液の化学量論とモル濃度を使用して計算できます。
Q: Ni(OH)2 はどのような電荷を表しますか?
A: Ni(OH)2 の電荷は中性またはゼロです。
Q: Ni(OH)2 のモル溶解度はどのように計算すればよいですか?
A: Ni(OH)2 のモル溶解度は、溶解した化合物のモル数を溶液の体積で割ることによって求めることができます。
Q: 方程式 NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s) の平衡形は何ですか?
A: 平衡方程式は 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s) です。
Q: Ni(OH)2 はモルあたり何グラムですか?
A: Ni(OH)2 のモル質量は約 92.6934 g/mol です。
Q: Ni(OH)2 は水に溶けますか?
A: いいえ、Ni(OH)2 は水に溶けません。
Q: 反応における還元剤は何ですか: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
A: 反応における還元剤はマグネシウム (Mg) です。
Q: Ni(OH)2 は固体ですか?
A: はい、Ni(OH)2 は固体化合物です。
Q: セルの電位が 25°C で 0.247 V の場合、Ni(OH)2 の Ksp はいくらですか?
A: Ni(OH)2 の Ksp は、ネルンストの式とセル電位を使用して決定できます。
Q: 純水よりも酸性溶液に溶けやすい塩はどれですか?
A: Ni(OH)2 のような塩は、酸との中和反応により、酸性溶液に溶けやすくなります。
