アジ化水素酸 (HN3) は揮発性の高い化合物です。無色で刺激臭があります。化学反応に使用され、有毒で爆発性がある可能性があります。
| IUPAC名 | アジ化水素酸 |
| 分子式 | HN3 |
| CAS番号 | 7782-79-8 |
| 同義語 | アゾイミド、アジ化水素、アゾト酸、硝酸、トリアゾン酸 |
| インチチ | InChI=1S/HN3/c1-3-2/h1H |
アジ化水素酸の性質
アジ化水素酸の式
アジ化水素酸の化学式は HN3 です。共有結合した 1 つの水素原子と 3 つの窒素原子から構成されます。この単純な式は化合物の基本組成を表しており、その特性と反応を理解するために非常に重要です。
アジ化水素酸モル質量
アジ化水素 (HN3) のモル質量は、1 モルあたり約 43.03 グラムです。この値は、1 つの水素原子 (H) と 3 つの窒素原子 (N) の原子量を加算することによって得られます。モル質量は、化学反応における化学量論を計算するために不可欠です。
アジ化水素酸の沸点
アジ化水素の沸点は比較的低く、摂氏約 37 度 (華氏 98.6 度) です。揮発性の性質により、中程度の温度で容易に気化してガス状になります。この化合物の取り扱いには細心の注意が必要です。
アジ化水素酸 融点
アジ化水素の融点は約摂氏 -80 度 (華氏 -112 度) です。この温度では、固体化合物は液体の形態に変化します。非常に反応性が高いため、固体状態では適切な保管と取り扱いが必要です。
アジ化水素酸の密度 g/mL
アジ化水素の密度は 1 ミリリットルあたり約 1.09 グラムです。この値は単位体積あたりの質量を示し、特定の空間におけるそのコンパクトさと集中度を反映します。これは実験室測定にとって重要なパラメータです。
アジ化水素酸の分子量
アジ化水素 (HN3) の分子量は 1 モルあたり 43.03 グラムです。これは、化合物の単一分子に存在する元素の原子量の合計です。分子量は、その物理的および化学的挙動を決定する上で重要な役割を果たします。
アジ化水素酸の構造
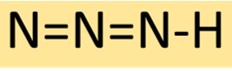
アジ化水素は、3 つの窒素原子が順番に結合し、末端に 1 つの水素原子が結合した直線状の分子構造を持っています。この配置により、安定だが反応性の高い化合物が得られ、化学合成でよく使用されます。
アジ化水素酸の溶解度
アジ化水素は水への溶解度が限られているため、難溶性の化合物です。水溶液に少量は溶解しますが、溶解度が低いため、用途によっては使用が制限されます。有毒で爆発性があるため、水性の形態を扱う場合は特別な注意が必要です。
| 外観 | 無色の液体 |
| 比重 | 1.09g/ml |
| 色 | 無色 |
| 匂い | 刺激臭 |
| モル質量 | 43.03 g/モル |
| 密度 | 1.09g/ml |
| 融合点 | -80°C (-112°F) |
| 沸点 | 37℃ (98.6°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | わずかに溶ける |
| 溶解性 | アルカリ性およびアルコール、エーテルなどの有機溶媒に可溶 |
| 蒸気圧 | 20℃で23.1mmHg |
| 蒸気密度 | 1.4 (空気 = 1) |
| pKa | 4.6 |
| pH | 3~4くらい |
アジ化水素酸の安全性と危険性
アジ化水素は重大な安全上のリスクをもたらします。毒性が高く、暴露されると深刻な健康影響を引き起こす可能性があります。その蒸気やミストを吸入すると、呼吸器への刺激、めまい、さらには死に至る可能性があります。皮膚や目に接触すると、火傷、炎症、組織損傷を引き起こす可能性があります。また、この化合物は非常に可燃性が高く、爆発性混合物を形成する可能性があります。金属や酸化剤などのさまざまな物質と激しく反応します。アジ化水素を取り扱うときは、事故や環境中への放出を避けるため、防護服の着用、適切な換気の使用、安全な保管などの適切な安全対策に従う必要があります。環境。
| ハザードシンボル | どくろ、腐食性 |
| セキュリティの説明 | 非常に有毒、腐食性 |
| 国連識別番号 | UN1687 |
| HSコード | 2811.29.10 |
| 危険等級 | 6.1 (有毒物質) |
| 梱包グループ | II(中危険) |
| 毒性 | 非常に有毒です。少量で致死的になる可能性がある |
アジ化水素酸の合成方法
さまざまな方法でアジ化水素を合成できます。
一般的なアプローチには、アジ化ナトリウム (NaN3)と硫酸 (H2SO4)や塩酸 (HCl) などの酸との反応が含まれます。この方法では、酸がアジ化ナトリウムと混合し、アジ化水素と使用される酸の対応する塩が形成されます。
別の方法には、アジ化ナトリウムとヨウ化メチル (CH3I) やヨウ化エチル (C2H5I) などのハロゲン化アルキルとの反応が含まれます。クルチウス転位として知られるこの反応は、生成物としてアジ化水素を生成します。
アジ化ナトリウムと亜硝酸 (HNO2) の反応により、アジ化水素が生成されます。その場で亜硝酸を生成するには、通常、亜硝酸ナトリウム (NaNO2) を酸性溶液に添加します。アジ化ナトリウムと亜硝酸の反応によりアジ化水素が生成されます。
アジ化水素の合成には注意深い取り扱いと適切な安全対策が必要であることに注意することが重要です。毒性と爆発性があるため、反応は換気の良い場所で、適切な保護具を使用し、確立されたプロトコルに従って行う必要があります。
各合成方法には利点と限界があり、方法の選択は試薬の入手可能性、望ましい収率、安全性の考慮事項などの要因によって決まります。これらの合成を効率的かつ安全に行うには、危険な化学物質の取り扱いに関する十分な理解と専門知識が不可欠です。
アジ化水素酸の用途
アジ化水素はそのユニークな特性により、さまざまな分野で応用されています。その用途の一部を次に示します。
- 化学試薬: アジ化水素は有機合成における多用途の化学試薬として機能し、医薬品や染料の重要な構成要素であるアジドの合成を含む多くの反応に積極的に関与します。
- 起爆剤と推進剤: メーカーは、エアバッグや安全装置に使用される起爆剤と推進剤の製造にアジ化水素を使用しています。アジ化水素は、その爆発性と急速な分解により積極的に窒素ガスを放出する利点があり、これらの用途では価値があります。
- 実験室分析: 分析化学では、さまざまな元素や化合物の積極的な検出と測定にアジ化水素が使用されます。特定の金属と積極的に錯体を形成し、比色法または滴定法による定量が可能になります。
- 生化学研究: 生化学研究では、科学者は生体分子を修飾し、その機能を研究するためにアジ化水素を積極的に使用します。特定の官能基と選択的に反応するため、生体分子の同定と特性評価に積極的に貢献します。
- 写真: 従来の白黒写真では、アジ化水素が乳剤の増感剤として積極的に機能し、写真フィルムの感光性を向上させ、画質の向上に積極的につながります。
- 腐食防止剤: 業界では、金属、特に銅とその合金の腐食防止剤としてアジ化水素を積極的に使用しています。金属表面に積極的に保護層を形成し、各種設備や構造物の腐食を積極的に防止し、寿命を延ばします。
- ガス発生器:アジ化水素は、エアバッグや救助システム用のガス発生器で活躍しています。急速な分解により窒素ガスが積極的に放出され、膨張と展開に必要な力が供給されます。
質問:
Q: アジ化水素酸は腐食性ですか?
A: はい、アジ化水素酸は腐食性であると考えられており、接触すると火傷や組織損傷を引き起こす可能性があります。
Q: アジ化水素酸は強酸ですか?
A: はい、アジ化水素酸は強酸として分類されており、水中で完全にイオン化してヒドロニウムイオンを放出する可能性があります。
Q: アジ化水素酸は三元酸ですか?
A: いいえ、アジ化水素酸は三成分酸ではありません。三元酸には 3 つの異なる元素 (水素、酸素、および 3 番目の元素) が含まれていますが、アジ化水素酸には水素、窒素、酸素のみが含まれています。
Q: 12.5mlあたりのアジ化水素酸は何mlですか?
A: 質問は不完全なようで、正確な回答を得るには追加情報が必要です。
Q: 形式電荷を含む、アジ化水素酸 (HN3) の正しいルイス構造は何ですか?
A: HN3 の正しいルイス構造は、他の 3 つの窒素原子と 1 つの水素原子に結合した中心の窒素原子で構成されます。形式電荷は、電気陰性度の違いに基づいて決定できます。
Q: アジ化水素酸はシトクロム C オキシダーゼにどのような影響を与えますか?
A: アジ化水素は、細胞呼吸に関与する酵素であるチトクローム C オキシダーゼの活性部位に結合してその機能を妨害することにより、その酵素を阻害します。
Q: 0.20 M のアジ化水素酸の pH が 3.21 の場合、アジ化水素酸の Ka はいくらですか?
A: アジ化水素酸の Ka は、pH と式 Ka = [H3O+][A-]/[HA] を使用して計算できます。 Ka 値を決定するには、さらに多くの情報が必要です。
Q: アジ化水素酸 (HN3) の窒素の酸化状態は何ですか?
A: アジ化水素酸の窒素の酸化状態は -1 です。
Q: Ka = 1.8 × 10^-9 の場合、HN3 の 0.15 モル溶液の pH はいくつですか?
A: HN3 の 0.15 モル溶液の pH は、Ka 値と式 pH = -log10(sqrt(Ka × [HA])) を使用して計算できます。
Q: N2 + H2 を HN3 にバランスさせるにはどうすればよいですか?
A: N2 + H2 → HN3 の反応の平衡式は、3N2 + 6H2 → 2HN3 になります。
Q: HN3 の Ka はどのように計算しますか?
A: HN3 の Ka は、HN3 解離反応における生成物と反応物の平衡濃度を使用して計算できます。
Q: HN3 のモル濃度が 0.012 M の場合、NaN3 のモル濃度はいくらですか?
A: NaN3 のモル濃度は、追加情報または NaN3 と HN3 の間の反応の平衡式がなければ決定できません。
Q: 形式電荷を含む、アジ化水素酸 (HN3) の正しいルイス構造は何ですか?
A: HN3 の正しいルイス構造には、他の 3 つの窒素原子と 1 つの水素原子に結合した中心の窒素原子が含まれます。形式電荷は、電気陰性度の違いに基づいて決定できます。
