二塩化硫黄 (SCl₂) は、硫黄と塩素を結合させることによって形成される化合物です。染料、ゴム、殺虫剤を製造するためにさまざまな産業で使用されています。
| IUPAC名 | 二塩化硫黄 |
| 分子式 | SCl₂ |
| CAS番号 | 10545-99-0 |
| 同義語 | 一硫化塩素、塩化亜硫酸、二塩化硫黄、塩化硫黄、ジクロロスルファン |
| インチチ | InChI=1S/Cl2S/c1-3-2 |
二塩化硫黄の性質
二塩化硫黄の式
塩化硫黄の化学式は SCl₂ です。 1 つの硫黄原子と 2 つの塩素原子の組み合わせを表します。この化学式は、化合物の組成と構造を正確に反映しています。
二塩化硫黄モル質量
塩化硫黄のモル質量は、構成元素の原子量を加算することで計算できます。硫黄のモル質量は 32.06 g/mol、塩素のモル質量は 35.45 g/mol です。 2 つの塩素原子と 1 つの硫黄原子の質量を加算することにより、塩化硫黄のモル質量は約 102.91 g/mol と決定されます。
二塩化硫黄の沸点
塩化硫黄の沸点は 138.8°C (281.8°F) です。この温度は、標準大気圧下で液体化合物が気体状態に変化する温度を示します。塩化硫黄を取り扱う場合やさまざまな用途に使用する場合には、塩化硫黄の沸点を考慮することが重要です。
二塩化硫黄 融点
塩化硫黄の融点は -76.8°C (-106.2°F) です。この温度は、固体化合物が液体状態に変化する温度を表します。塩化硫黄を扱う場合、適切な取り扱いと保管を確保するために、融点を知ることが不可欠です。
二塩化硫黄の密度 g/mL
塩化硫黄の密度は約 1.64 g/mL です。密度値は、物質の単位体積あたりの質量を示します。この特性は、化学反応中や特定の用途への適合性の判断など、さまざまな状況における塩化硫黄の挙動と特性を理解するために不可欠です。
二塩化硫黄の分子量
塩化硫黄の分子量は約 102.91 g/mol です。これは、構成元素の原子量を加算することによって計算される、化合物の分子の総質量を表します。分子量は化合物の質量に関する貴重な情報を提供し、さまざまな化学計算における正確な測定を可能にします。
二塩化硫黄の構造
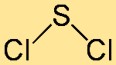
塩化硫黄の構造は、湾曲した、または V 字型の分子として最もよく説明されます。それは、2 つの塩素原子に結合した中心の硫黄原子から構成されます。原子の配置と結合角は、化合物の全体的な安定性と反応性に寄与します。
二塩化硫黄の溶解度
塩化硫黄は水への溶解度が限られています。溶解性が低く、水と混合すると白濁する傾向があります。化合物の溶解特性は、他の物質との適合性やさまざまな溶媒中での挙動を判断する際に考慮することが重要です。
| 外観 | 黄色の液体 |
| 比重 | 1.64g/ml |
| 色 | 黄色 |
| 匂い | エーカー |
| モル質量 | 102.91 g/モル |
| 密度 | 1.64g/ml |
| 融合点 | -76.8℃ |
| 沸点 | 138.8℃ |
| フラッシュドット | 利用不可 |
| 水への溶解度 | 反応する |
| 溶解性 | 氷酢酸、ベンゼン、臭素に可溶 |
| 蒸気圧 | 35.4mmHg |
| 蒸気密度 | 3.9 (空気=1) |
| pKa | 利用不可 |
| pH | 利用不可 |
二塩化硫黄の安全性と危険性
塩化硫黄はいくつかの安全上のリスクを引き起こすため、慎重に取り扱う必要があります。非常に腐食性が高く、皮膚、目、粘膜に接触すると重度の火傷を引き起こす可能性があります。その蒸気を吸入すると、呼吸器系を刺激し、咳、呼吸困難、肺損傷を引き起こす可能性があります。また、可燃性でもあり、特定の物質の存在下で発火する可能性があります。塩化硫黄を扱う場合は、手袋、ゴーグル、呼吸保護具などの適切な保護具を使用する必要があります。事故や潜在的な損傷を避けるために、この化合物は発火源や不適合物質から離れた、換気の良い場所で取り扱い、保管することが重要です。
| ハザードシンボル | 腐食性 |
| セキュリティの説明 | 接触を避け、保護具を着用し、換気の良い場所で作業してください。 |
| 国連識別番号 | 1828年 |
| HSコード | 2812.10.00 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 非常に有毒です |
二塩化硫黄の合成方法
塩化硫黄を合成するにはいくつかの方法があります。一般的なアプローチには、硫黄と塩素ガスの反応が含まれます。このプロセスでは、硫黄を特定の温度、通常約 200 ~ 250°C (392 ~ 482°F) に加熱するときに過剰な塩素が存在します。反応が進行して塩化硫黄が生成します。
別の方法には、塩化チオニル (SOCl2)と硫黄の間の反応が含まれます。塩化チオニルは塩素源として機能し、硫黄と反応して塩化硫黄を生成します。この反応は、直接硫黄-塩素法よりも比較的低い温度で起こります。
塩化スルフリル (SO2Cl2) と硫化水素 (H2S) の反応により、塩化硫黄が製造されます。この反応は高温で起こり、塩化硫黄やその他の副生成物が生成されます。
関係者の安全を確保するには、設備の整った実験室または工業環境で塩化硫黄の合成を行うことが重要です。この化合物の危険な性質のため、担当者は保護具の着用や換気の良い場所での作業など、適切な安全予防措置に従う必要があります。
合成方法の選択は、原材料の入手可能性、製品の望ましい純度、特定の用途要件などのさまざまな要因によって異なります。各方法には独自の利点と考慮事項があるため、適切な手法の選択はプロセスまたはアプリケーションの特定のニーズによって異なります。
二塩化硫黄の用途
塩化硫黄 (SCl₂) は、その特有の特性により、さまざまな産業やプロセスで用途が見出されます。塩化硫黄の主な用途をいくつか紹介します。
- 染料製造: メーカーは塩化硫黄を使用して染料、特に繊維産業の生地に鮮やかな色を与える硫化染料を製造します。
- ゴム産業: ゴム産業では、ポリマー鎖を架橋することでゴム製品の強度と弾性を向上させる加硫剤として SCl₂ を使用しています。
- 殺虫剤の合成: 塩化硫黄は特定の殺虫剤の合成において重要な役割を果たし、有機リン酸塩化合物や有機チオリン酸塩と呼ばれる殺虫剤や殺菌剤の製造を可能にします。
- 化学合成: SCl2 はさまざまな化学反応で多用途の試薬として機能し、アルコールの塩化アルキルへの変換や塩素化有機化合物の合成などの塩素化反応を可能にします。
- 実験室用試薬: 実験室では、有機合成、硫黄化学、無機反応などの複数の用途の試薬として塩化硫黄を使用します。
- 水処理: 水処理プロセスでは、水源から有害な微生物や有機汚染物質を除去するために、殺菌剤および酸化剤として SCl₂ を使用します。
- 製薬産業: 塩化硫黄は、医薬品の研究開発、特に特定の医薬品有効成分 (API) の合成に応用されています。
- 化学分析: ガスクロマトグラフィーなどの分析化学技術では、SCl2 を使用して特定の化合物を検出および分析します。
これらのさまざまな用途は、さまざまな工業プロセスや科学的取り組みにおける塩化硫黄の重要性を浮き彫りにしています。ただし、塩化硫黄は危険な性質を持っているため、適切な安全ガイドラインと手順に従って慎重に取り扱い、使用することが重要です。
質問:
Q: 二塩化硫黄の式は何ですか?
A: 塩化硫黄の化学式は SCl₂ です。
Q: 二塩化硫黄という分子化合物を表す式は何ですか?
A: 分子化合物塩化硫黄は式 SCl2 で表されます。
Q: 二塩化硫黄は極性がありますか?
A: はい、塩化硫黄は湾曲した分子構造と不均一な電子密度分布の存在により極性があります。
Q: 二塩化硫黄 (SCl2) の S と Cl の間のシグマ結合を構成する原子軌道または混成軌道は何ですか?
A: 塩化硫黄(SCl₂)における硫黄(S)と塩素(Cl)のシグマ結合は、硫黄の3p軌道と塩素の3p軌道が重なることで形成されます。
Q: SCl₂ は線形ですか?
A: いいえ、塩化硫黄 (SCl₂) は線状ではありません。湾曲した、または V 字型の分子幾何学形状を持っています。
Q: イオン性化合物は次のうちどれですか? Cl2O、CH2O、SCl2、PF5、Mg3(PO4)2。
A: リストされている化合物はどれもイオン性化合物ではありません。これらは分子化合物 (Cl2O、CH2O、SCl2、PF5) または無機リン酸塩化合物 (Mg3(PO4)2) のいずれかです。
Q: 化学式 SCl₂ の化合物の名前は何ですか?
A: 化学式 SCl2 の化合物は塩化硫黄と呼ばれます。
Q: SCl₂ の形式は何ですか?
A: SCl₂ は曲線または V 字型の分子形状をしています。
Q: SCl₂ の分子構造は何ですか?
A: SCl2 の分子構造は湾曲または V 字型です。
Q: SCl₂ の硫黄が使用する混成軌道の名前は何ですか?
A: SCl2 の硫黄原子は sp2 混成軌道を使用します。
Q: 1 つの硫黄原子が 2 つの塩素原子と結合して SCl₂ を生成するとどうなりますか?
A: 1 つの硫黄原子が 2 つの塩素原子と結合すると、塩化硫黄として知られる化合物 SCl2 が形成されます。硫黄原子は塩素原子と電子を共有して、それらの間に共有結合を形成します。
