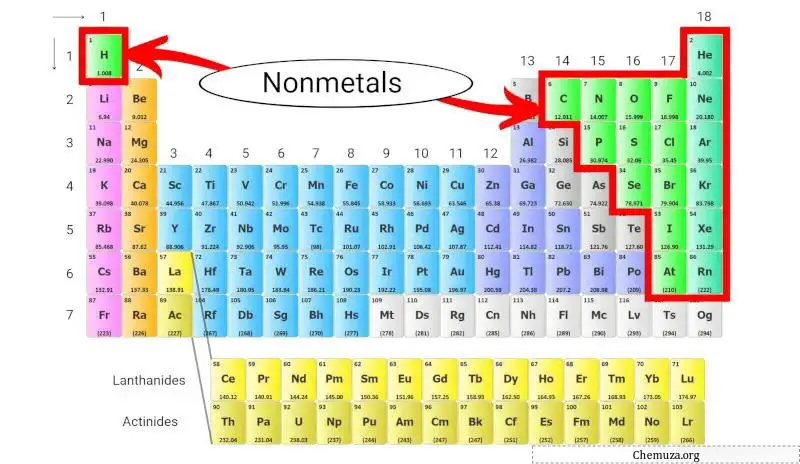
非金属は、高い導電性や光沢などの金属の特性を持たない元素のグループです。これらの非金属は、水素を除いて、周期表の右側に位置します。
非金属は、酸素や塩素などの気体、臭素などの液体、硫黄や炭素などの固体など、さまざまな形で存在します。 [1]
非金属についてもっと重要なことを見てみましょう。
非金属とは一体何でしょうか?
非金属は、化学反応中に電子を獲得し、マイナスに帯電したイオンまたはアニオンを形成する傾向のある元素です。
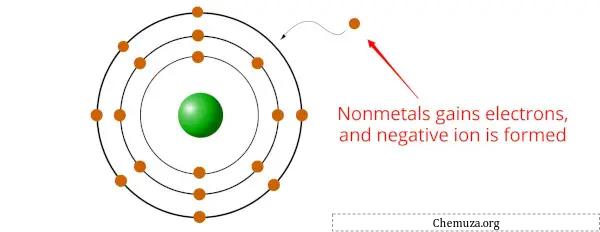
これは、非金属は一般に金属よりも電気陰性度が高いためです[2] 。これは、非金属が電子を引き寄せる力が大きいことを意味します。
非金属が金属と結合すると、非金属元素は金属から 1 つ以上の電子を獲得して、安定した化合物を形成します。
たとえば、塩素はナトリウムから電子を受け取り、イオン性化合物である塩化ナトリウム (NaCl) を形成します。
また、非金属は、金属の物理的および化学的特性を持たない化学元素のグループであるとも言えます。
さて、周期表に存在する非金属のリストを見てみましょう。
周期表に存在する非金属のリスト
周期表に存在する非金属のリストは次のとおりです。
- 水素(H)
- ヘリウム(He)
- カーボン(C)
- 窒素(N)
- 酸素(O)
- フローライト(F)
- ネオン(Ne)
- リン(P)
- 硫黄(S)
- 塩素(Cl)
- アルゴン (Ar)
- セレン(Se)
- 臭素(Br)
- クリプトン (Kr)
- ヨウ素(I)
- キセノン(Xe)
- アスタチン (At)
- ラドン (Rn)
これらの非金属は、周期表の上部に位置し、アルカリ金属の上に位置する水素を除いて、周期表の右側に位置します。
非金属の状態 (固体、液体、気体?)
非金属は、固体、液体、気体の 3 つの状態すべてで存在できます。
非金属の状態は、非金属がさらされる温度と圧力の条件によって異なります。
周期表上のすべての非金属の中で。
- 11種類の非金属は室温で気体状態です。 [3]
- 臭素 (Br) は、室温で液体の状態で存在する非金属です。
- 残りの非金属は室温で固体です。
最も反応性の高い非金属
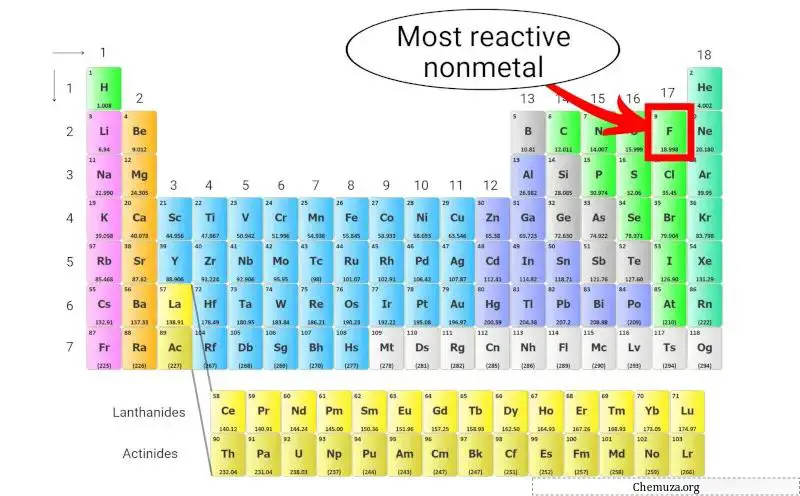
フッ素(F) は、周期表に存在する非金属の中で最も反応性が高いです。
しかし、なぜ?なぜフッ化物が最も反応性が高いのでしょうか?
これは、すべての元素の中で最も電気陰性度が高く、電子を引き付ける力が強いためです。
フッ素はその最外側のエネルギー準位に 7 つの電子を持ち、その価電子殻を満たして安定した配置に達するには追加の電子が必要です。
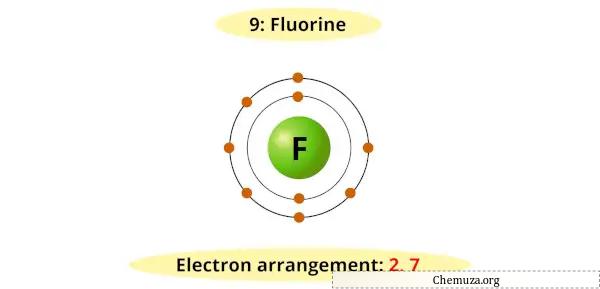
そのため、他の元素から電子を受け取りやすくフッ化物イオン(F-)を形成します。
フッ素は反応性が高いため、水、金属、さらにはガラスを含む他の多くの元素や化合物と爆発的に反応する可能性があります。 [4]
フッ素は非常に反応性が高いため、通常、その腐食特性に耐性のある材料で作られた専用の容器に入れて保管および輸送されます。
環境および産業用途における非金属の役割
非金属は、その独特の特性により、さまざまな産業プロセスや環境用途で使用されています。ここではいくつかの例を示します。
- 大気汚染の制御:窒素や酸素などの非金属は、大気汚染の制御に重要な役割を果たします。窒素酸化物 (NOx) は、車両や産業プロセスから放出される有害な汚染物質です。非金属触媒は、NOx を窒素や水などの無害なガスに変換するために使用されます。同様に、酸素は有害な排出物を削減するために燃焼プロセスで使用されます。
- 肥料:窒素、リン、硫黄は植物の成長に不可欠な栄養素です。硝酸アンモニウムや過リン酸塩などの非金属肥料は、作物の収量を増やすために農業で広く使用されています。
- バッテリー:バッテリーには硫黄、炭素、リチウムなどの非金属元素が使用されます。リチウムイオン電池は、電子機器、電気自動車、再生可能エネルギーシステムで一般的に使用されています。
- 浄水:塩素やヨウ素などの非金属は、浄水システムの消毒剤として一般的に使用されます。有害な細菌やウイルスを殺し、水を安全に飲めるようにします。 [5]
- 化学製造:硫黄や塩素などの非金属は、硫酸、塩酸、塩素系溶剤などの化学薬品の製造に広く使用されています。
まとめ
非金属は金属のような高い電気伝導率や光沢などの性質を持たず、水素を除いて周期表の右側に位置します。それらは、温度と圧力の条件に応じて、物質の 3 つの状態すべてで存在します。
フッ素は電気陰性度が高いため最も反応性の高い非金属であり、他の元素から電子を容易に受け取り、フッ化物イオン (F-) を形成します。
非金属は、大気汚染防止、肥料、電池、水の浄化、化学製造など、環境および産業用途でいくつかの用途があります。
