酸化銀 (Ag2O) は、銀と酸素から構成される化合物です。さまざまな化学反応における酸化剤および触媒として一般に使用されます。
| IUPAC名 | 酸化銀(I) |
| 分子式 | Ag2O |
| CAS番号 | 11113-88-5 |
| 同義語 | 一酸化銀;酸化銀 (1+);ジオキソシルバー;酸化銀、二銀。酸素 (2-) |
| インチチ | InChI=1S/2Ag.O |
酸化銀の性質
酸化銀の配合
一酸化銀の化学式はAg2Oです。 1 つの酸素 (O) 原子に結合した 2 つの銀 (Ag) 原子から構成されます。この式は、化合物中に存在する元素の比率を表します。
酸化銀のモル質量
一酸化銀のモル質量は、その構成元素の原子質量を加算することによって計算されます。銀の原子量は 107.87 g/mol、酸素の原子量は 16.00 g/mol です。したがって、一酸化銀のモル質量は約 231.87 g/mol です。
酸化銀の沸点
一酸化銀は沸点に達する前に分解するため、明確な沸点を持ちません。加熱すると化学反応が起こり、金属銀と酸素ガスに分解します。
酸化銀の融点
一酸化銀の融点は約 280°C (536°F) です。この温度では、固体の一酸化銀が液体状態に変わります。融点は、固体から液体に変化する温度を示します。
酸化銀の密度 g/mL
一酸化銀の密度は約 7.14 g/mL です。この値は、単位体積あたりの化合物の質量を表します。一酸化銀の密度が高いのは、銀の原子量が重いためです。
酸化銀の分子量
一酸化銀の分子量は、その構成元素の原子量を加算して計算されます。 Ag2O の分子量は約 231.87 g/mol です。化合物の 1 モルの質量に関する情報が得られます。
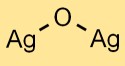
酸化銀の構造
一酸化銀は結晶構造を持っています。銀原子と酸素原子が格子状に並んでいます。この構造は、Ag^+ カチオンと O^2- アニオンがイオン結合で結合したもので構成されています。
酸化銀の溶解度
一酸化銀は水に溶けにくいです。ある程度溶解して水酸化銀(AgOH)を生成します。一酸化銀の溶解度は、酸性またはアルカリ性溶液を使用して可溶性銀塩に変換することで改善できます。
| 外観 | ソリッドブラックまたはダークブラウン |
| 比重 | 7.14 g/cm3 |
| 色 | 黒 |
| 匂い | 無臭 |
| モル質量 | 231.87 g/モル |
| 密度 | 7.14 g/cm3 |
| 融合点 | 280°C (536°F) |
| 沸点 | 分解された |
| フラッシュドット | 適用できない |
| 水への溶解度 | 難溶性 |
| 溶解性 | 酸性またはアルカリ性溶液に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
酸化銀の安全性と危険性
一酸化銀を取り扱うときは、安全を確保するための予防措置を講じてください。飲み込んだり吸入すると有害であり、皮膚、目、呼吸器系を刺激する可能性があります。ほこりや煙の蓄積を防ぐために、適切な換気を確保してください。化合物との接触を最小限に抑えるために、手袋やゴーグルなどの保護具を着用してください。一酸化銀は、可燃性物質や不適合物質から離れた涼しく乾燥した場所に保管してください。飲み込んだり、吸入したり、皮膚に接触した場合は、直ちに医師の診察を受けてください。環境汚染を避けるために、適切な取り扱いおよび廃棄手順に従ってください。
| ハザードシンボル | なし |
| セキュリティの説明 | 飲み込んだり吸入すると有害です。 |
| 国連識別番号 | 適用できない |
| HSコード | 2841.90.90 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 中程度の毒性 |
酸化銀の合成方法
一酸化銀を合成するにはいくつかの方法があります。
一般的なアプローチには、硝酸銀 (AgNO3)などの可溶性銀塩と水酸化ナトリウム (NaOH)などのアルカリ性水酸化物との反応が含まれます。反応は銀塩と水酸化アルカリの水溶液を混合することによって進行し、一酸化銀の沈殿が形成されます。沈殿物を収集し、乾燥すると固体の一酸化銀が得られます。
別の方法には、硝酸銀や炭酸銀などの銀化合物の熱分解が含まれます。化合物を特定の温度で加熱して一酸化銀生成物を形成します。分解プロセスでは、使用した出発化合物に応じて、二酸化窒素 (NO2) または二酸化炭素 (CO2) が放出されます。
電気分解を利用して一酸化銀を合成します。この方法では、硝酸銀を含むことが多い適切な電解質溶液に浸した銀電極に電流を流す必要があります。銀電極の酸化が起こり、電極表面に一酸化銀が形成されます。
合成方法の選択は、一酸化銀の目的の純度、収率、特定の用途などの要因に依存することに注意してください。合成中は、適切な保護具の使用や推奨手順に従うなど、適切な安全上の注意事項に従ってください。
酸化銀の用途
一酸化銀は、その独特の特性によりさまざまな用途に使用されます。一酸化銀の用途をいくつか紹介します。
- 酸化剤: 有機合成反応では通常、アルコールをアルデヒドまたはケトンに変換する酸化剤として一酸化銀が使用されます。
- 触媒: 一酸化銀は、アルケンやアルデヒドの酸化やニトロ化合物の還元など、さまざまな化学反応において触媒として機能します。
- 電池: ボタン電池は、エネルギー密度と安定性が高い一酸化銀を陰極材料として使用します。
- 抗菌剤: 一酸化銀は抗菌特性を示し、創傷被覆材、医療機器、浄水システムなどの用途に役立ちます。
- 導電性ペースト: プリント基板や厚膜抵抗器などの電子製品の製造では、導電性ペーストに一酸化銀が使用されます。
- 写真産業: 写真産業では、特に白黒写真において、感光特性を目的として一酸化銀が使用されています。
- 火工品: 火工品混合物では、一酸化銀を使用して花火に特殊な効果と色を生み出します。
- 化学試薬: 研究室では、さまざまな分析および合成手順の化学試薬として一酸化銀が使用されます。
- ガラス製造: ミラー コーティングなどの特殊ガラスには、反射特性があるため一酸化銀が使用されます。
- 銀メッキ: 銀メッキの用途では、耐久性のある耐腐食性のコーティングを提供するために一酸化銀が使用されることがあります。
これらのさまざまな用途は、さまざまな産業における一酸化銀の多用途性と重要性を浮き彫りにしています。
質問:
Q: Ag2O は水に溶けますか?
A: Ag2O は水に溶けにくいです。
Q: P=745 mmHg および T=308K で 4.58 L の O2 が生成された場合、何グラムの Ag2O が分解しますか?
A: 分解された Ag2O の質量は、化学量論と理想気体の法則を使用して計算できます。
Q: Ag2O はイオン性ですか?
A: はい、Ag2O はイオン性化合物です。
Q: なぜ脱銀ではなく酸化銀と呼ばれるのでしょうか?
A: 二元イオン化合物の命名規則では、「di-」のような接頭辞は使用されません。これが酸化銀と呼ばれる理由です。
Q: Ag2O と反応できない二糖はどれですか?
A: Ag2O は主に有機合成において酸化剤として使用されるため、二糖類とは反応しません。
Q: 酸化銀とは何ですか?
A: 一酸化銀 (Ag2O) は銀と酸素で構成される化合物で、酸化剤や触媒としてよく使用されます。
Q: アルカリと酸化銀は互換的に使用できますか?
A: アルカリと酸化銀は化学的性質や用途が異なるため、互換性がない場合があります。
Q: 0.632 モルの鉛が酸化されて硝酸鉛(II) になると、何モルの銀が堆積しますか?
A: 平衡方程式の化学量論により、堆積される銀のモル数が決まります。
Q:いぶし銀はどれくらい長持ちしますか?
A: いぶし銀の寿命は環境条件やメンテナンスなどのさまざまな要因によって決まりますが、適切なお手入れをすることで長期間保存することができます。
