酸化リチウム (Li2O) は、リチウムと酸素からなる化合物です。強いイオン特性を示し、電気化学ポテンシャルが高いため電池に広く使用されています。
| IUPAC名 | 酸化リチウム |
| 分子式 | Li2O |
| CAS番号 | 12142-77-7 |
| 同義語 | 酸化リチウム(I);酸化ジリチウム;リティア;オキソリリチウム; UNII-06T3K8P3KU |
| インチチ | InChI=1S/2Li.O |
酸化リチウムの配合
酸化リチウムの配合
酸化二リチウムの化学式はLi2Oです。 2 つのリチウム (Li) 原子と 1 つの酸素 (O) 原子の組み合わせを表します。このシンプルで安定した化合物は、さまざまな産業用途に不可欠です。
酸化リチウムのモル質量
Li2O のモル質量は約 29.88 g/mol です。これは、2 つのリチウム原子 (それぞれ 6.94 g/mol) と 1 つの酸素原子 (16.00 g/mol) の原子量を加算することによって計算されます。
酸化リチウムの沸点
酸化ダイリチウムの沸点は摂氏約 2,463 度 (華氏 4,465 度) です。この非常に高い沸点により、極度の耐熱性が必要な産業で役立ちます。
酸化リチウムの融点
酸化ダイリチウムの融点は約摂氏 1,450 度 (華氏 2,642 度) です。この温度にさらされると、固体から液体の状態に変化し、さまざまな製造プロセスが容易になります。
酸化リチウムの密度 g/mL
酸化ダイリチウムの密度は約 2.01 g/mL です。この値は単位体積あたりの化合物の質量を表し、その特性と用途を決定するために不可欠です。
酸化リチウムの分子量
Li2O の分子量は 29.88 g/mol です。構成元素であるリチウムと酸素の原子量の合計です。この値により、化学量論的な計算が容易になります。
酸化リチウムの構造
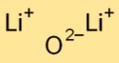
酸化ダイリチウムは単純なイオン結晶構造を持っています。これは、強い静電力によって結合されたリチウム陽イオン (Li+) と酸化物陰イオン (O2-) で構成されています。この配置は、その安定性と導電性に貢献します。
酸化リチウムの溶解度
酸化ジリチウムは水への溶解度が低いです。水と反応して水酸化リチウムを形成し、その溶解を制限します。ただし、一部の非水溶媒や溶融塩にはある程度の溶解性を示します。
結論として、酸化ジリチウムはさまざまな特性と用途を持つ重要な化合物です。その安定した構造、高い融点と沸点により、セラミック、ガラス製造などの産業や特殊な電池の部品として価値があります。その特性を理解することで、その可能性をさまざまな目的に活用することができます。
| 外観 | 白色固体 |
| 比重 | 2.01g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 29.88 g/モル |
| 密度 | 2.01g/ml |
| 融合点 | 1,450°C (2,642°F) |
| 沸点 | 2463°C (4465°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水と反応する |
| 溶解性 | 水への溶解度が低く、水酸化リチウムの形態 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 適用できない |
| pH | 適用できない |
引火点、蒸気圧、蒸気密度、pKa、pH などの一部の特性は、その化学的性質と挙動のため、Li2O には適用できない、または利用できないことに注意してください。
酸化リチウムの安全性と危険性
酸化ダイリチウムには、安全性に関する一定の懸念と危険性があります。水と強く反応して、腐食性の水酸化リチウムを生成し、皮膚や目に炎症を引き起こす可能性があります。その粉塵や煙を吸入すると、呼吸器官への炎症を引き起こす可能性があります。この化合物は非常に有毒なものとして分類されていませんが、皮膚や目との接触を避けるために注意して取り扱う必要があります。酸化リチウムを扱う場合は、適切な換気と個人用保護具が不可欠です。誤って摂取した場合は、直ちに医師の診察が必要です。さらに、火災や爆発の潜在的な危険を避けるために、不適合物質から遠ざけて保管する必要があります。
| ハザードシンボル | 腐食性 |
| セキュリティの説明 | 水と反応する。皮膚や目の炎症を引き起こします。取り扱い注意。粉塵や煙の吸入を避けてください。 |
| 国連識別番号 | 適用できない |
| HSコード | 2825.70.00 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | Ⅲ |
| 毒性 | 毒性はそれほど強くありませんが、注意が必要です。摂取したり、皮膚や目との接触を避けてください。 |
酸化リチウムの合成方法
酸化ジリチウムはさまざまな方法で合成できます。
一般的なアプローチには、高温でリチウム金属を酸素または空気と反応させることが含まれます。このプロセスでは、酸素ガスがリチウム金属の加熱を促進し、酸化ジリチウムが形成されます。
別の方法は、高温での炭酸リチウムや水酸化リチウムなどのリチウム塩の熱分解です。これらの塩を加熱すると分解して酸化ジリチウムが生成します。
さらに、酸化ジリチウムを製造するには、水酸化リチウムを前駆体として使用できます。まず加熱によって脱水され、目的の酸化物の形に変わります。
別の技術には、リチウムを含む鉱物または鉱石の使用が含まれます。化学プロセスによりこれらの天然資源からリチウム化合物が抽出され、さらに処理されて酸化ジリチウムが生成されます。
各合成方法には、コスト、効率、純度の点で特有の利点と課題がある可能性があることに注意することが重要です。科学者や技術者は、特定の産業または研究の要件を満たす酸化ダイリチウムの最も適切な製造方法を選択する際に、これらの要素を考慮します。
酸化リチウムの用途
酸化リチウム (Li2O) は、その独特の特性により、さまざまな産業で多用途に使用されています。以下に主な用途をいくつか示します。
- セラミック産業: 酸化ダイリチウムはセラミックの重要な成分であり、セラミックの機械的強度と熱安定性を向上させます。また、調理温度が下がり、製造プロセス中のエネルギーも節約されます。
- ガラス生産: ガラス産業では、酸化ジリチウムがフラックスとして機能し、ガラスの溶融温度を下げ、化学的攻撃に対する耐性を向上させ、高品質のガラス製品をもたらします。
- 電池技術: 酸化ジリチウムは、リチウムイオン電池の製造において前駆体として機能します。これはバッテリーの正極材料に寄与し、それによってエネルギー貯蔵容量と全体的な性能が向上します。
- 乾燥剤: 酸化ダイリチウムは水との親和性が高いため、エアコンやガス精製システムなどの特定の環境から湿気を除去するために使用される効果的な乾燥剤です。
- 冶金: 冶金プロセスでは、酸化ジリチウムは不純物を除去することで金属の精製に役立ちます。
- 特殊ガラス: 光学、電子機器、科学機器などのさまざまな用途向けの特殊ガラスの製造には、酸化リチウムが使用されます。
- 触媒: 酸化ジリチウムは、特定の化学反応において触媒として機能し、反応物質から目的の生成物への変換を促進します。
- 原子力産業: 原子力産業では、酸化ダイリチウムは中性子減速材として機能し、核分裂反応の速度を制御します。
用途の多様性は、技術、製造、科学研究の進歩における酸化ジリチウムの重要性を浮き彫りにしています。そのユニークな特性はさまざまな業界でイノベーションを推進し続けており、幅広い実用用途を持つ貴重な化合物となっています。
質問:
Q: 酸素とリチウムの反応から酸化リチウムが形成されることを示す式は何ですか?
A: 4Li + O2 → 2Li2O
Q: 酸化リチウム、Li2O のモル質量は何ですか?
A: Li2O のモル質量は約 29.88 g/mol です。
Q: 酸化リチウムの式は何ですか?
A: 酸化ジリチウムの化学式は Li2O です。
Q: 酸化リチウムはイオン性ですか、それとも共有結合性ですか?
A: 酸化リチウムはイオン性です。
Q: イオン結合におけるリチウムの酸化数は何ですか?
A: イオン結合におけるリチウムの酸化数は +1 です。
Q: Li2O のリチウムの配位数は何ですか?
A: Li2O のリチウムの配位数は 4 です。
Q: Li2O はイオン性ですか、それとも共有結合性ですか?
A: Li2O はイオン性です。
Q: 次の反応のうち、Li2O の格子エネルギー (ΔH°latt) に関連するものはどれですか?
A: 反応: Li+(g) + O2-(g) → Li2O(s)
Q: 酸化リチウム、Li2O のモル質量は何ですか?
A: Li2O のモル質量は約 29.88 g/mol です。
Q: リチウム金属 (Li) を燃焼させると次のうちどれが生成されますか? O2、LiO、H2O、Li2O?
A: 金属リチウム(Li)が燃焼すると、Li2Oが生成されます。
Q: 4.5 モルの Li2O は何グラムですか?
A: 4.5 モルの Li2O には約 134.46 グラムが含まれます。
