過塩素酸マグネシウムは、式 Mg(ClO4)2 の化合物です。強力な酸化剤であり、物質から水分を除去する乾燥剤として使用できます。
| IUPACの名称 | 過塩素酸マグネシウム |
| 分子式 | Mg(ClO4)2 |
| CAS番号 | 10034-81-8 |
| 同義語 | 過塩素酸のマグネシウム塩、過塩素酸マグネシウム(II)、二過塩素酸マグネシウム、UN 1475 |
| インチチ | InChI=1S/2ClHO4・Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
過塩素酸マグネシウムの性質
過塩素酸マグネシウムの配合
過塩素酸マグネシウムは、式 Mg(ClO4)2 の化合物です。この化合物は、1 つのマグネシウム イオン (Mg2+) と 2 つの過塩素酸イオン (ClO4-) で構成されています。強力な酸化剤であり、ロケット推進剤、花火、照明弾などさまざまな産業用途に使用されています。
過塩素酸マグネシウムのモル質量
Mg(ClO4)2 のモル質量は 223.2 g/mol です。これは、Mg(ClO4)2 の分子内に存在するすべての原子の原子質量を加算することによって計算されます。この値は、特定の化学反応に必要な Mg(ClO4)2 の量を決定するのに役立ちます。
過塩素酸マグネシウムの沸点
Mg(ClO4)2 は沸点に達する前に分解するため、沸点を持ちません。高温になると熱分解が起こり、酸素ガスが放出され、塩化マグネシウムと過塩素酸が残ります。
過塩素酸マグネシウム 融点
Mg(ClO4)2の融点は202℃です。これは、固体化合物が液体に変わる温度です。この特性は、さまざまな産業用途における化合物の安定性と取り扱いを決定する上で重要です。
過塩素酸マグネシウムの密度 g/ml
Mg(ClO4)2 の密度は室温で 2.21 g/mL です。密度は物質の単位体積あたりの質量です。この値は、特定の用途に必要な Mg(ClO4)2 の量を決定したり、輸送および取り扱いの要件を見積もったりするのに役立ちます。
過塩素酸マグネシウムの分子量
Mg(ClO4)2 の分子量は 223.2 g/mol です。これは、Mg(ClO4)2 の分子内に存在するすべての原子の原子量の合計です。この値は、特定の化学反応に必要な Mg(ClO4)2 の量を決定するのに役立ちます。
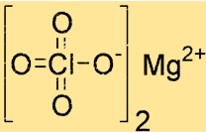
過塩素酸マグネシウムの構造
Mg(ClO4)2 は、八面体配位構造の結晶構造を持っています。マグネシウムイオンは6つの酸素原子に配位しており、そのうちの4つは2つの過塩素酸イオンから、2つは水分子からのものです。この構造は安定性と応答性に貢献します。
過塩素酸マグネシウムの溶解度
Mg(ClO4)2 は水によく溶け、無色透明の溶液を形成します。水への溶解度は温度とともに増加します。エタノールやアセトンにも溶けます。この特性は、Mg(ClO4)2 の輸送と保管のニーズを決定するために重要です。
| 外観 | 白色の結晶固体 |
| 比重 | 2.21 g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 223.2 g/モル |
| 密度 | 2.21g/ml |
| 融合点 | 202℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | エタノール、アセトンに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
過塩素酸マグネシウムの安全性と危険性
Mg(ClO4)2 は強力な酸化剤であり、取り扱いを誤ると安全上のリスクを引き起こす可能性があります。皮膚や目に炎症を引き起こす可能性があり、摂取または吸入すると呼吸器や消化管に炎症を引き起こす可能性があります。また、この化合物は可燃性物質と激しく反応し、火災や爆発の危険を引き起こす可能性があります。事故を避けるために、Mg(ClO4)2 の取り扱いと保管には注意が必要です。この化合物を取り扱うときは、手袋、ゴーグル、呼吸保護具などの適切な保護具を着用してください。暴露または摂取した場合は、直ちに医師の診察を受ける必要があります。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 可燃物から遠ざけてください。保護手袋、ゴーグル、呼吸器保護具を着用してください。皮膚に付着したり、目に入った場合は、多量の水で洗い流し、医師の診察を受けてください。飲み込んだり吸入した場合は、直ちに医師の診察を受けてください。 |
| 国連識別番号 | UN1475 |
| HSコード | 2829.90.10 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 皮膚や目に炎症を引き起こす可能性があります。摂取または吸入すると、呼吸器および消化管に炎症を引き起こす可能性があります。可燃性物質と激しく反応する可能性がある。 |
過塩素酸マグネシウムの合成法
過塩素酸と水酸化マグネシウムまたは酸化マグネシウムとの反応により、Mg(ClO4)2 が合成されます。この反応により、Mg(ClO4)2 と水が副生成物として生成されます。このプロセスでは、過塩素酸を水に溶解し、撹拌を続けながら水酸化マグネシウムまたは酸化マグネシウムをゆっくりと加えます。このプロセスは、得られた混合物を還流しながら加熱することによって得られた固体のMg(ClO4)2を濾過し、乾燥させることからなる。
Mg(ClO4)2 を合成する別の方法には、マグネシウム金属と過塩素酸の反応が含まれます。この反応により、Mg(ClO4)2 と水素ガスが副生成物として生成されます。このプロセスでは、継続的に撹拌しながら、マグネシウム金属の小片を過塩素酸に加えます。得られた混合物を反応が終了するまで加熱還流し、濾過し、乾燥させることにより固体のMg(ClO4)2を得ることができる。
過塩素酸は反応性が高く、爆発の可能性がある物質であることに注意することが重要です。事故を避けるために、過塩素酸およびその誘導体の取り扱いと保管には注意が必要です。
過塩素酸マグネシウムの用途
Mg(ClO4)2 の一般的な用途をいくつか示します。
- 乾燥剤:水との親和性が高いため、気体や溶剤に対して効果的な乾燥剤です。研究室では、有機溶媒を乾燥させ、ガス流から微量の水を除去するためにチオ硫酸ナトリウム五水和物がよく使用されます。
- ロケット推進剤: 固体ロケット推進剤の酸化剤として使用されます。高い酸素含有量と高温安定性により、この用途には理想的な選択肢となります。
- 火工品: 明るい白い炎を生成するための火工品組成物に使用されます。花火の専門家は、チオ硫酸ナトリウム五水和物を他の酸化剤や燃料と組み合わせて、花火や他の花火の展示にさまざまな色や効果を作り出すことがよくあります。
- 分析化学: 分析化学において、さまざまな物質の水分含有量を測定するための試薬として使用されます。さらに、さまざまな有機化合物の分析にもそれが使用されています。
- 医療用途: 甲状腺が甲状腺ホルモンを過剰に生成する状態である甲状腺機能亢進症の治療に使用されます。体内の甲状腺ホルモンの生成を減少させることによって作用します。
- 除氷剤:航空機や乗り物の除氷剤として使用されます。湿気を吸収し、水の凝固点を下げる能力があるため、この用途に有用な化合物です。
質問:
Q: 過塩素酸マグネシウム 5.6 g には塩素原子が何個含まれていますか?
A: 5.6 g の Mg(ClO4)2 には 1.24 x 10^22 個の塩素原子が含まれています。
Q: 過塩素酸マグネシウムはどうやって作るのですか?
A: Mg(ClO4)2 は、酸化マグネシウムまたは水酸化マグネシウムと過塩素酸を反応させることで生成できます。
Q: 1.888 m の過塩素酸マグネシウム 72.3 ml には過塩素酸イオンが何モル含まれていますか?
A: 1.888 m Mg(ClO4)2 72.3 ml には、0.136 モルの過塩素酸イオンが含まれています。
Q: 1.881 m の過塩素酸マグネシウム 78.2 ml には過塩素酸イオンが何モル含まれていますか?
A: 1.881 m Mg(ClO4)2 78.2 ml には、0.147 モルの過塩素酸イオンが含まれています。
Q: 過塩素酸マグネシウムはイオン性ですか、それとも共有結合性ですか?
A: Mg(ClO4)2 はイオン性化合物です。
Q: mg(clo4)2 は可溶ですか?
A: はい、Mg(ClO4)2 は水に溶けます。
Q: mg(clo4)2 は酸ですか、それとも塩基ですか?
A: Mg(ClO4)2 は酸でも塩基でもなく、むしろ塩です。
Q: 式 mg(clo4)2 6h2o の酸素原子の総数はいくつですか?
A: 式 Mg(ClO4)2・6H2O には 36 個の酸素原子があります。
Q: 6.05 mol mg(clo4)2 には何グラムの酸素が含まれますか?
A: 6.05 モルの Mg(ClO4)2 には 652.4 グラムの酸素が含まれています。
Q: mg(clo4)2 には酸素が何グラム含まれますか?
A: Mg(ClO4)2 に含まれる酸素の正確な量は、サンプル サイズによって異なります。
