過塩素酸カルシウム (Ca(ClO4)2) は、花火やロケット推進剤など、多くの用途がある化合物です。水によく溶けるので乾燥剤としても使えます。
| IUPAC名 | 過塩素酸カルシウム |
| 分子式 | Ca(ClO4)2 |
| CAS番号 | 13477-36-6 |
| 同義語 | カルチョフォス、過塩素酸のカルシウム塩、二過塩素酸カルシウム、過塩素酸カルシウム (II)、UN1459 |
| インチチ | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
過塩素酸カルシウムの性質
過塩素酸カルシウム配合
過塩素酸カルシウムの式は Ca(ClO4)2 です。 1 つの Ca2+ イオンと 2 つの ClO4- イオンで構成されます。カルシウムイオンは 2+ の正電荷を持ち、各 ClO4- イオンは 1- の負電荷を持ちます。この式は、過塩素酸カルシウムの化学構造を表すために使用されます。
過塩素酸カルシウムのモル質量
Ca(ClO4)2 のモル質量は 238.98 g/mol です。この値は、アボガドロ数の分子を含む 1 モルの Ca(ClO4)2 の質量を表します。モル質量は、特定の反応に必要な Ca(ClO4)2 の量を決定する際に重要です。
過塩素酸カルシウムの沸点
Ca(ClO4)2 は沸点に達する前に分解するため、沸点を持ちません。加熱すると塩化カルシウム、酸素ガス、塩素ガスに分解します。この分解反応は強い発熱を伴い、かなりの量の熱を放出します。
過塩素酸カルシウム 融点
Ca(ClO4)2の融点は200℃です。この温度は、固体の Ca(ClO4)2 が液体状態に変化する温度です。融点は、乾燥剤として使用できるかどうかなど、Ca(ClO4)2 の物理的特性を決定する際に重要です。
過塩素酸カルシウムの密度 g/mL
Ca(ClO4)2 の密度は 2.505 g/mL です。この値は、Ca(ClO4)2 の単位体積あたりの質量を表します。 Ca(ClO4)2 の密度は水の密度よりも大きいため、水に沈みます。
過塩素酸カルシウムの分子量
Ca(ClO4)2 の分子量は 238.98 g/mol です。この値は、Ca(ClO4)2 分子内のすべての原子の原子量の合計を表します。分子量は、特定の反応に必要な Ca(ClO4)2 の量を決定する際に重要です。
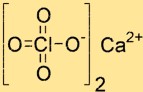
過塩素酸カルシウムの構造
Ca(ClO4)2 の構造は、1 つの Ca2+ イオンと 2 つの ClO4- イオンで構成されます。 Ca2+ イオンは構造の中心に位置し、2 つの ClO4- イオンに由来する 4 つの酸素原子に囲まれています。 ClO4- イオンは四面体の形状をしており、酸素原子によってカルシウムイオンに結合しています。
過塩素酸カルシウムの溶解度
Ca(ClO4)2 は水への溶解度が高く、20℃での溶解度は 121 g/100 mL です。この溶解性により、周囲から水を吸収できるため、乾燥剤として役立ちます。ただし、エタノールやアセトンなどの有機溶媒には溶けません。
| 外観 | 白色の結晶固体 |
| 比重 | 2,505g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 238.98 g/モル |
| 密度 | 2,505g/ml |
| 融合点 | 200℃ |
| 沸点 | 沸点前に分解する |
| フラッシュドット | 適用できない |
| 水への溶解度 | 121 g/100 mL(20℃) |
| 溶解性 | 有機溶剤に不溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 利用不可 |
| pH | 適用できない |
過塩素酸カルシウムの安全性と危険性
Ca(ClO4)2 はいくつかの安全上のリスクを引き起こすため、取り扱う際には適切な安全対策を講じる必要があります。これは強力な酸化剤であり、可燃性物質と反応して火災や爆発を引き起こす可能性があります。その粉塵や蒸気を吸入すると気道に炎症を引き起こす可能性があり、皮膚に接触すると炎症や火傷を引き起こす可能性があります。また、摂取すると消化管の炎症や腐食を引き起こし有害です。 Ca(ClO4)2 を取り扱うときは、手袋やゴーグルなどの適切な個人用保護具を着用し、可燃性物質や不適合物質から遠ざけて保管する必要があります。
| ハザードシンボル | 酸化剤、飲み込むと有害 |
| セキュリティの説明 | 可燃性物質や不適合物質から遠ざけてください。手袋と保護メガネを着用してください。粉塵や煙の吸入を避けてください。目に入った場合は、多量の水で洗い、必要に応じて医師の診察を受けてください。 |
| 国連識別番号 | UN1502 |
| HSコード | 2829.9000 |
| 危険等級 | 5.1 – 酸化性物質 |
| 梱包グループ | Ⅱ |
| 毒性 | 飲み込むと有害、皮膚や呼吸器系を刺激する |
過塩素酸カルシウムの合成方法
Ca(ClO4)2は、水酸化カルシウムと過塩素酸または過塩素酸アンモニウムを反応させることによって合成できます。
1つの方法は、反応容器内で炭酸カルシウムを過塩素酸と反応させ、続いて溶液を濾過および蒸発させて固体生成物を得るステップを含む。
別の方法には、酸化カルシウムと過塩素酸水溶液との反応、続いて得られた生成物の濾過および乾燥が含まれる。
場合によっては、Ca(ClO4)2 は、反応容器内で塩化カルシウムと過塩素酸ナトリウムを反応させることによって合成できます。反応後に生成物を濾過し、乾燥させてCa(ClO4)2を得ることができる。
Ca(ClO4)2 を合成するもう 1 つの一般的な方法には、塩化カルシウムと過塩素酸アンモニウムの反応が含まれ、副生成物として Ca(ClO4)2 と塩化アンモニウムが生成されます。高純度の Ca(ClO4)2 を生成できるため、火工品用途ではこの方法が好まれます。
過塩素酸は有機物質と反応して火災や爆発を引き起こす可能性のある強力な酸化剤であるため、過塩素酸を扱う場合は適切な安全対策を講じる必要があることに注意することが重要です。
過塩素酸カルシウムの用途
Ca(ClO4)2 は、さまざまな産業や用途でいくつかの用途があります。 Ca(ClO4)2 の用途には次のようなものがあります。
- 火工品: 酸素含有量が高く安定しているため、酸化剤として火工品で一般的に使用されます。
- 肥料: 植物の成長に必須の栄養素であるカルシウムと塩素を提供する肥料として使用されます。
- ロケット燃料: 酸素含有量が高く安定しているため、ロケット燃料の成分として使用されます。
- 石油精製: 石油産業で原油やその他の炭化水素から硫黄化合物を除去するために使用されます。
- エアバッグ インフレーター: すぐに分解してガスを発生する能力があるため、エアバッグ インフレーターの製造に使用されます。
- フレア: 酸素含有量が高く安定しているため、フレアの製造に使用されます。
- 金属表面処理:錆やその他の不純物を除去するための金属表面の処理に使用されます。
- 実験室での用途: 過塩素酸の調製や乾燥剤など、さまざまな実験室での用途に使用されます。
質問:
Q: 過塩素酸カルシウムの式は何ですか?
A: Ca(ClO4)2。
Q: 過塩素酸カルシウムはイオン性ですか、それとも共有結合性ですか?
A: Ca(ClO4)2 は、カルシウムカチオン (Ca2+) と過塩素酸アニオン (ClO4-) で構成されているため、イオン性化合物です。
Q: 過塩素酸カルシウムはどのように処分すればよいですか?
A: Ca(ClO4)2 は、患部を水で洗い、残った微量の化合物を重炭酸ナトリウムなどの弱塩基で中和することで除去できます。
Q: 過塩素酸カルシウムは溶けますか?
A: はい、Ca(ClO4)2 は水やその他の極性溶媒に溶けます。水への溶解度は、室温で水 100 mL あたり約 120 g です。
Q: 過塩素酸カルシウムと水はどのような反応を起こしますか?
A: Ca(ClO4)2 と水は通常の状態では反応しません。
Q: 0.650 モルの Ca(ClO4)2 には塩素原子が何個ありますか?
A: 0.650 モルの Ca(ClO4)2 には 5.88 x 10^23 個の塩素原子が含まれています。
Q: Ca(ClO4)2 のモル質量はどれくらいですか?
A: Ca(ClO4)2 のモル質量は 238.98 g/mol です。
Q: 0.073 M HCl と 0.0090 M Ca(ClO4)2 を含む溶液中の H の活量係数は何ですか?
A: 0.073 M HCl と 0.0090 M Ca(ClO4)2 を含む溶液中の H の活量係数は、温度およびその他の要因に依存します。熱力学モデルと実験データを使用して計算できます。
Q: 26.0 グラムの Ca(ClO4)2 は何モルですか?
A: 26.0 グラムの化合物中に 0.109 モルの Ca(ClO4)2 が含まれています。
