過塩素酸カリウム (KClO4) は、カリウム、塩素、酸素を含む化合物です。酸化特性があるため、花火や爆発物によく使用されます。
| IUPACの名称 | 過塩素酸カリウム |
| 分子式 | KClO4 |
| CAS番号 | 7778-74-7 |
| 同義語 | パーカル K、過塩素酸カリ、塩素酸カリウム (VII)、UN 1489 |
| インチチ | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
過塩素酸カリウムの性質
過塩素酸カリウムの配合
過塩素酸カリウムの化学式は KClO4 で、カリウム原子 1 つ、塩素原子 1 つ、酸素原子 4 つが含まれていることを示します。この化合物は水への溶解度が高い無機塩であるため、多くの用途で有用な酸化剤となります。
過塩素酸カリウムのモル質量
KClO4 のモル質量は、化合物の構成元素の原子質量を加算することによって計算されます。カリウム、塩素、酸素の原子量は、それぞれ 39.10 g/mol、35.45 g/mol、16.00 g/mol です。したがって、KClO4 のモル質量は 138.55 g/mol です。
過塩素酸カリウムの沸点
KClO4 は沸点に達する前に分解するため、定義された沸点がありません。高温に加熱すると、KClO4 は塩化カリウムと酸素ガスに分解します。ただし、この化合物は約 400 ~ 500 °C の温度で昇華する可能性があることが観察されています。
過塩素酸カリウム 融点
KClO4 の融点は約 610°C です。この温度では、固体化合物は液体状態に変わります。 KClO4 は融点が高いため、さまざまな産業用途での使用に適しています。
過塩素酸カリウムの密度 g/mL
KClO4 の密度は室温で約 2.52 g/cm3 です。これは、この化合物の密度が 1 g/cm3 である水よりも密度が高いことを示しています。 KClO4 は密度が高いため、火工品において効果的な酸化剤となります。
過塩素酸カリウムの分子量
KClO4 の分子量は 138.55 g/mol です。この値は、化合物の構成元素の原子量を加算することによって決定されます。 KClO4 の分子量は、特定の反応またはプロセスに必要な化合物の質量を決定するのに役立ちます。
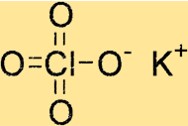
過塩素酸カリウムの構造
KClO4 は正方晶の結晶構造を持ち、c 軸の周りに 4 回対称であることを意味します。この化合物の結晶格子は、イオン結合によって結合されたカリウム イオン、塩素イオン、酸素イオンで構成されています。
過塩素酸カリウムの溶解度
KClO4 は水への溶解度が高く、室温での溶解度は約 4.5 g/mL です。この化合物は、エタノールやアセトンなどの他の極性溶媒にも可溶です。ただし、ベンゼンやクロロホルムなどの非極性溶媒には溶けません。 KClO4 の溶解度は、さまざまな産業用途で酸化剤として KClO4 を使用する際の重要な要素です。
| 外観 | 白色の結晶固体 |
| 比重 | 2.52 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 138.55 g/モル |
| 密度 | 2.52 g/cm3 |
| 融合点 | 610℃ |
| 沸点 | 沸点前に分解する |
| フラッシュドット | 適用できない |
| 水への溶解度 | 4.5 g/mL(25℃) |
| 溶解性 | エタノール、アセトンに可溶、ベンゼン、クロロホルムに不溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 中性 |
過塩素酸カリウムの安全性と危険性
KClO4 は、適切に取り扱わないと安全上のリスクを引き起こす可能性があります。この化合物は強力な酸化剤であり、可燃性物質と反応して火災や爆発を引き起こす可能性があります。 KClO4 の粉塵や蒸気を吸入すると、呼吸器系に炎症を引き起こす可能性があります。この化合物に長期間曝露すると、皮膚の炎症や皮膚炎を引き起こす可能性があります。 KClO4 を取り扱う場合は、手袋、安全メガネ、マスクなどの適切な個人用保護具を使用することが重要です。また、コンパウンドは、不適合物質や熱源、発火源から離れた、涼しく乾燥した場所に保管する必要があります。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 可燃物から遠ざけてください。適切な個人用保護具を着用してください。粉塵や煙を吸い込まないようにしてください。 |
| 国連識別番号 | UN1489 |
| HSコード | 2829.90.90 |
| 危険等級 | 5.1 – 酸化性物質 |
| 梱包グループ | Ⅱ |
| 毒性 | 長時間暴露すると皮膚の炎症や皮膚炎を引き起こす可能性があります。この化合物を摂取または吸入すると、呼吸器への刺激を引き起こす可能性があります。 |
過塩素酸カリウムの合成方法
KClO4 はさまざまな方法で合成できます。
一般的な方法は、塩素酸カリウムと過塩素酸バリウムを反応させることです。この反応により、副生成物として KClO4 と塩化バリウムが生成されますが、これらは濾過できます。
別の方法には、塩素酸カリウムと塩酸および塩化ナトリウムとの反応が含まれます。この反応により KClO4 と塩素酸ナトリウムが生成されますが、これらは結晶化によって分離できます。
水酸化カリウムと過塩素酸アンモニウムの反応でも KClO4 を合成できます。この反応により KClO4 と水酸化アンモニウムが生成されますが、これらは濾過によって分離できます。
別の方法には、触媒の存在下での塩化カリウムと過塩素酸ナトリウムの反応が含まれます。この反応により KClO4 と塩化ナトリウムが生成されますが、これらは結晶化によって分離できます。
過塩素酸カリウムの用途
KClO4 は、さまざまな業界でさまざまな用途に使用されます。一般的な用途には次のようなものがあります。
- 火工品: 火工品業界でよく使われる酸化剤。花火、照明弾、その他の種類の爆発物の製造に使用されます。
- ロケットプロペラ: ロケット推進剤の製造において酸化剤として使用されます。固体ロケットブースターやスペースシャトルの打ち上げによく使用されます。
- エアバッグイニシエーター: エアバッグの製造においてイニシエーターとして使用されます。エアバッグを展開するには、KClO4 でコーティングされたワイヤを通じて電荷が送信されます。これにより反応が起こり、窒素ガスが発生し、エアバッグが膨張します。
- マッチ: 安全マッチの製造に使用されます。粗い表面にぶつかると発火する可燃性化合物を生成するために、硫化アンチモンと硫黄が混合されます。
- 電気めっき: 金属の電気めっきに使用される電解液の成分として電気めっき業界で使用されます。
- 薬: 甲状腺機能亢進症などの甲状腺疾患の治療に使用されます。しかし、安全性への懸念から医療での使用は減少しています。
- 分析化学: 特定の物質を測定するための分析化学の試薬としても使用されます。
質問:
Q: 過塩素酸カリウムの分子にはどのような結合が含まれていますか?
A: KClO4 にはイオン結合と共有結合の両方が含まれています。 K+ イオンと ClO4- イオンはイオン結合によって結合されていますが、過塩素酸イオン自体には共有結合とイオン結合の両方が含まれています。
Q: 過塩素酸カリウムの式は何ですか?
A: KClO4。
Q: 過塩素酸カリウムは水性ですか?
A: KClO4 は水に溶解し、特定の条件下では水っぽくなります。
Q: 過塩素酸カリウムは何に使用されますか?
A: KClO4 には、花火、ロケットブースター、エアバッグインフレーターなど、さまざまな用途があります。分析化学において試薬および酸化剤としても使用されます。
Q: 過塩素酸カリウムを使わずにフラッシュパウダーを作るにはどうすればよいですか?
A: フラッシュパウダーは、KClO4 を使用せずに、過塩素酸アンモニウム、過塩素酸ナトリウム、過酸化バリウムなどの代替酸化剤を使用して作成できます。
Q: KClO4 の個々の塩素原子の酸化状態は何ですか?
A: KClO4 の個々の塩素原子の酸化状態は +7 です。
Q: KClO4 は水に溶けますか?
A: はい、KClO4 は水に溶けます。
Q: KClO4 は酸ですか、それとも塩基ですか?
A: KClO4 は酸でも塩基でもありません。金属(カリウム)と多原子イオン(過塩素酸塩)からなる塩です。
