臭化カルシウムは、化学式 CaBr2 の化合物です。これは白色で無臭の可溶性固体であり、臭化物イオン源としてさまざまな産業で使用されています。
| IUPACの名称 | 臭化カルシウム |
| 分子式 | CaBr2 |
| CAS番号 | 7789-41-5 |
| 同義語 | 二臭化カルシウム;ブロモカルシウム |
| インチチ | InChI=1S/Ca.2BrH/h;2*1H/q+2;;/p-2 |
臭化カルシウムの性質
臭化カルシウムの配合
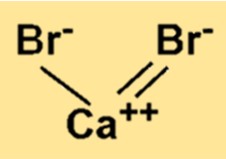
臭化カルシウムの化学式は CaBr2 です。この式は、カルシウム イオンが 2 つの臭化物イオンとイオン結合によって結合していることを示しています。化合物の式は、化合物の分子または式単位に存在する原子の種類と数を表します。
臭化カルシウムのモル質量
CaBr2 のモル質量は 199.89 g/mol です。この値は、1 つのカルシウム原子 (40.08 g/mol) と 2 つの臭素原子 (それぞれ 79.90 g/mol) の原子量を加算することによって計算されます。モル質量は、化合物 1 モル中に存在する物質の量を決定するため、あらゆる化合物にとって重要な特性です。
臭化カルシウムの沸点
CaBr2 の沸点は 1193°C (2179°F) です。 CaBr2 はイオン性のため沸点が高くなります。イオン性化合物は、正に帯電したイオンと負に帯電したイオンの間に強い静電気力を持っています。これらの力は分解するのに多くのエネルギーを必要とするため、沸点が高くなります。
臭化カルシウムの融点
CaBr2 の融点は 730°C (1,346°F) です。化合物の融点は、化合物が固体状態から液体状態に変化する温度です。 CaBr2 は、そのイオン性により比較的高い融点を持っています。イオン間の強い静電気力に打ち勝つには多量のエネルギーが必要となり、その結果融点が高くなります。
臭化カルシウムの密度 g/mL
CaBr2 の密度は 3.353 g/mL です。密度は単位体積あたりの物質の質量です。 CaBr2 の高密度は、そのイオン性とイオンの密な配置によるものです。
臭化カルシウムの分子量
CaBr2 の分子量は 199.89 g/mol です。この値は、1 つのカルシウム原子と 2 つの臭素原子の原子量を加算することによって計算されます。分子量は、化合物の分子内に存在する物質の量を決定するため、あらゆる化合物にとって必須の特性です。
臭化カルシウムの構造
CaBr2 は Ca2+ イオンと Br- イオンから構成される結晶格子構造を持っています。 Ca2+ イオンは 6 つの Br- イオンに囲まれ、各 Br- イオンは 6 つの Ca2+ イオンに囲まれています。このイオンの配置により、イオン間に強いイオン結合が形成されます。
| 外観 | 白色固体 |
| 比重 | 3,353g/mL |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 199.89 g/モル |
| 密度 | 3,353g/mL |
| 融合点 | 730°C (1,346°F) |
| 沸点 | 1,193°C (2,179°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | アルコール、アセトン、エーテルに可溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 適用できない |
| pH | 7 (ニュートラル) |
臭化カルシウムの安全性と危険性
CaBr2 は一般に、正しく取り扱われれば安全であると考えられています。ただし、適切に取り扱われたり使用されなかった場合、健康上のリスクが生じる可能性があります。 CaBr2 を吸入または摂取すると、それぞれ気道と胃腸管を刺激する可能性があります。 CaBr2 と皮膚が長時間接触すると、炎症や皮膚炎を引き起こす可能性があります。 CaBr2 は強力な酸化剤と激しく反応し、有毒ガスを発生する可能性もあります。 CaBr2 を取り扱うときは、手袋やゴーグルなどの適切な個人用保護具を着用する必要があります。また、不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | 皮膚の炎症を引き起こします。重度の眼刺激を引き起こします。飲み込んだり吸入すると有害です。呼吸器への刺激を引き起こす可能性があります。 |
| 国連識別番号 | UN3261 |
| HSコード | 28275900 |
| 危険等級 | 8 (腐食性) |
| 梱包グループ | Ⅲ |
| 毒性 | 低〜中程度の毒性。 |
臭化カルシウムの合成方法
CaBr2 を合成するにはさまざまな方法がありますが、最も一般的な方法には、炭酸カルシウムまたは水酸化カルシウムと臭化水素酸の反応が含まれます。このプロセスでは、CaBr2 と水が唯一の副生成物として生成されます。反応は、反応物の完全な変換を確実にするために、一定の撹拌と加熱を伴う制御された環境で行われます。
別の方法には、酸化カルシウムと臭化水素酸の反応が含まれます。このプロセスでは、副産物として CaBr2 と水も生成されます。反応は最初の方法と似ており、継続的な撹拌と加熱が必要です。
3 番目の方法には、カルシウムと臭素の反応が含まれます。臭素は反応性が高く、慎重な取り扱いが必要なため、この方法はあまり一般的ではありません。この反応により、唯一の生成物として CaBr2 が生成されます。
これらの方法はすべて、危険な化学物質や潜在的に危険な反応を伴うため、慎重な取り扱いと安全上の予防措置が必要です。合成された CaBr2 は、不純物を除去して純度を確保するために、使用前に精製する必要があります。最終製品の純度によって、その品質と意図された用途に対する有効性が決まります。
臭化カルシウムの用途
CaBr2 は、その独特の化学的特性により、さまざまな産業でさまざまな用途に使用されています。 CaBr2 の一般的な用途には次のようなものがあります。
- 石油およびガス産業: 石油およびガス産業で、掘削および仕上げ作業中に坑井圧力を制御する仕上げ流体として使用されます。
- 薬: てんかんやその他の神経系障害を治療するための鎮静剤および抗けいれん剤として医学的に使用されます。
- 写真: 臭化銀乳剤の調製のための増感剤として写真に使用されます。
- 化学合成: エステル化、アルキル化、縮合などのさまざまな化学反応の触媒として使用されます。
- 難燃剤: 火災の危険を軽減するために、プラスチック、繊維、その他の材料の難燃剤として使用されます。
- 食品産業: 微生物の増殖や腐敗を防ぐための食品保存料として使用されます。
- 冷凍:吸収冷凍システムの冷媒として使用されます。
- 水処理: スイミングプールやその他の水系における藻類や細菌の増殖を防ぐための水処理に使用されます。
質問:
Q: 化合物臭化カルシウムを表す式は何ですか?
A: 臭化カルシウムの化学式は CaBr2 です。
Q: 臭化カルシウムは水に溶けますか?
A: はい、CaBr2 は水に溶けます。水への溶解度が高く、20℃での溶解度は約121 g/100 mLです。
Q: 臭化カルシウムは水性ですか?
A: CaBr2 は、水に溶解すると水溶液を形成して水状態で存在できます。
Q: 臭化カルシウムは溶けますか?
A: はい、CaBr2 は水、エタノール、アセトンなどのさまざまな溶媒に可溶です。
Q: 臭化カルシウムとリン酸カリウムの水溶液を混合すると、どのような沈殿が形成されますか?
A: CaBr2 とリン酸カリウムの水溶液を混合すると、リン酸カルシウムの白い沈殿が形成されます。この反応の平衡化学式は次のとおりです。
CaBr2(aq) + K3PO4(aq) → 2KBr(aq) + Ca3(PO4)2(s)
