臭化カリウム (KBr) は、カリウムと臭素から構成される化合物です。犬の抗けいれん薬として写真、医学、獣医学で一般的に使用されています。
| IUPAC名 | 臭化カリウム |
| 分子式 | KBr |
| CAS番号 | 7758-02-3 |
| 同義語 | 臭化カリウム、臭化カリウム塩、臭化カリウム、臭化カリウム |
| インチチ | InChI=1S/BrH.K/h1H;/q;+1/p-1 |
臭化カリウムの性質
臭化カリウムの配合
臭化カリウムの化学式はKBrです。この式は化合物中の原子の比率を表します。 K+ イオンは +1 の電荷を持ち、Bri- イオンは -1 の電荷を持ち、中性の化合物になります。式は化合物の組成を示すために使用され、バランスのとれた化学方程式を書くために不可欠です。
臭化カリウムのモル質量
KBr のモル質量は 119.01 g/mol です。 1 つのカリウム原子と 1 つの臭素原子で構成されています。モル質量は、特定のサンプル中の物質のモル数を決定するために使用されるため、化合物の重要な特性です。化学量論では、化学反応における生成物または反応物の質量を計算するためにも使用されます。
臭化カリウムの沸点
KBr の沸点は 1,390 °C (2,534 °F) です。この高い沸点は、化合物のイオン性によるものです。加熱すると、カリウムと臭素間のイオン結合が切断されるために多量のエネルギーが必要となり、沸点が高くなります。 KBr は沸点が高いため、実験室で熱伝達流体として一般的に使用されています。
臭化カリウム 融点
KBr の融点は 734°C (1,353°F) です。沸点と同様に、融点もカリウム原子と臭素原子の間のイオン結合の強さによって決まります。加熱するとイオン結合が弱まり、化合物の結晶格子構造が崩れ、液体状態になります。
臭化カリウムの密度 g/mL
KBr の密度は室温で 2.75 g/mL です。物質の密度は、単位体積あたりの物質の質量として定義されます。 KBr の高密度は、化合物の緻密な結晶構造によるものです。この性質を利用して、レンズやプリズムなどの光学材料の製造に役立ちます。
臭化カリウムの分子量
KBr の分子量は 119.01 g/mol です。この値は、カリウムと臭素の原子量を加算することによって計算されます。分子量は、特定の濃度の溶液を調製するために必要な物質の量を決定するなどの化学計算に使用されます。
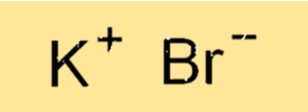
臭化カリウムの構造
KBrは面心立方格子からなる結晶構造を持っています。各 K+ イオンは 6 つの Br- イオンに囲まれ、各 Bri- イオンは 6 つの K+ イオンに囲まれています。この配置はイオン化合物の特徴であり、結晶構造内にイオンが規則正しく繰り返し配置されています。
| 外観 | 白色の結晶固体 |
| 比重 | 2.75 g/mL(25℃) |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 119.01 g/モル |
| 密度 | 2.75 g/cm3 |
| 融合点 | 734°C (1,353°F) |
| 沸点 | 1390°C (2534°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 53 g/100 mL(20℃) |
| 溶解性 | アルコール、アセトン、アンモニアに可溶 |
| 蒸気圧 | 1114℃で1mmHg |
| 蒸気密度 | 適用できない |
| pKa | 7.5(25℃にて) |
| pH | 7 (ニュートラル) |
臭化カリウムの安全性と危険性
KBr は一般に安全に使用できると考えられていますが、取り扱いを誤ると危険を引き起こす可能性があります。これは皮膚、目、呼吸器への刺激物であり、摂取すると胃腸障害を引き起こす可能性があります。高濃度に長期間曝露すると、呼吸器疾患を引き起こす可能性があります。 KBr は慎重に取り扱う必要があり、化合物を取り扱う際には手袋や防塵マスクなどの適切な個人用保護具を着用する必要があります。 KBr を涼しく乾燥した換気の良い場所で、不適合物質から離して保管することも重要です。暴露した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | Xi – イライラする |
| セキュリティの説明 | 皮膚や目との接触を避けてください。適切な保護服、手袋、ゴーグル/フェイスシールドを着用してください。 |
| 保護。 | |
| 国連識別番号 | UN 1465 (化学物質、臭化カリウム) |
| HSコード | 28275100 |
| 危険等級 | 6.1 (有毒物質) |
| 梱包グループ | Ⅲ |
| 毒性 | LD50 (経口、ラット) = 2.340 mg/kg |
臭化カリウムの合成方法
KBrを合成するには、直接合成、二重分解、酸塩基滴定などのさまざまな方法を使用できます。
直接合成では、 KOH がHBr ガスと反応して KBr を生成します。この反応により、副生成物としてKBrと水が生成されます。
二重分解には、可溶性カリウム塩と、塩化カリウムや臭化ナトリウムなどの可溶性臭化物塩との反応が含まれます。この反応により、KBr と塩化ナトリウムが生成されます。
酸塩基滴定には、臭化物塩とKOHの反応が含まれます。希硫酸はまず臭化物塩を処理してHbrを形成し、次に表題のKOHを処理してKBrと水を生成します。
KBrを合成する別の方法には、臭素を水酸化カリウムの熱溶液と反応させることが含まれます。亜硫酸ナトリウムは臭素酸カリウムを還元し、KBrと臭素酸カリウムを生成します。
臭化カリウムの用途
KBr はその独特の特性により、さまざまな産業でさまざまな用途に使用されています。 KBr の一般的な使用例をいくつか示します。
- 写真: 印画紙の曇りを防ぐ写真定着剤として白黒写真に広く使用されています。
- 獣医学: 発作に苦しんでいる犬や猫の抗けいれん薬として使用されます。
- 分析化学: 有機化合物を識別するためのフーリエ変換赤外分光法 (FTIR) の参照標準として使用されます。
- 医薬品化学: 鎮静剤、睡眠薬、抗てんかん薬などのさまざまな医薬品の調製に使用されます。
- 石油掘削: 地層水の流入を防ぎ、腐食のリスクを軽減するために、石油掘削の仕上げ液として使用されます。
- 難燃剤: プラスチック、繊維、紙製品の難燃剤として使用されます。
- 化学合成: 化学合成反応、特にさまざまな有機および無機化合物の合成にも使用されます。
質問:
Q: 臭化カリウムはどのような条件下で電気を通すことができますか?
A: KBr は、溶融状態または水に溶解しているときに電気を通すことができ、そのイオンが自由に移動して電荷を運ぶことができます。
Q: KBr はイオン性ですか、それとも共有結合性ですか?
A: KBr は、カリウムから臭素への電子の移動によって形成されるイオン性化合物です。
Q: KBrは水に溶けますか?
A: はい、KBr は水への溶解度が高く、25°C での溶解度は 53.5 g/100 mL です。
Q: 臭化カリウムの式は何ですか?
A: 臭化カリウムの化学式はKBrです。
Q: KBr は酸ですか、それとも塩基ですか?
A: KBr は塩であり、酸性や塩基性の性質を持ちません。
Q:KBrとは何ですか?
A: KBr は臭化カリウムの化学記号です。臭化カリウムは、その独特の特性によりさまざまな産業で使用されるイオン化合物です。
Q: 250.0 mL の 1.50 M KBr 溶液を調製するには、どのくらいの KBr の質量 (グラム単位) が必要ですか?
A: 1.50 M KBr を 250.0 ml の水に溶かした溶液を調製するには、30.4 グラムの KBr を水に溶かす必要があります。
