硫酸 (H2SO4) またはビトリオール油は、肥料生産、石油精製、金属加工などのさまざまな工業プロセスで一般的に使用される、腐食性が高く強力な鉱酸です。強力な脱水剤でもあります。
| IUPAC名 | 硫酸 |
| 分子式 | H2SO4 |
| CAS番号 | 7664-93-9 |
| 同義語 | 硝酸油、無水硫酸、重硫酸 |
| インチチ | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
硫酸の性質
硫酸の配合
硫酸の化学式は H2SO4 で、2 つの水素原子、1 つの硫黄原子、4 つの酸素原子を表します。この式は、硫酸分子の組成とその化学構造を表します。
硫酸のモル質量
硫酸のモル質量は 98.08 g/mol です。硫酸(H2SO4)の化学式に各元素の原子量を加算して計算されます。
硫酸の沸点
硫酸の沸点は337.1℃です。この温度では、液体の蒸気圧が大気圧に達し、沸騰し始めます。
硫酸の融点
硫酸の融点は10.4℃です。室温では非常に粘稠な液体ですが、より低い温度では凍結して固体状態を形成することがあります。
硫酸の密度 g/ml
硫酸の密度は、その濃度に応じて 1.84 g/mL から 1.93 g/mL まで変化します。硫酸の濃度が増加すると、その密度も増加します。
硫酸の分子量
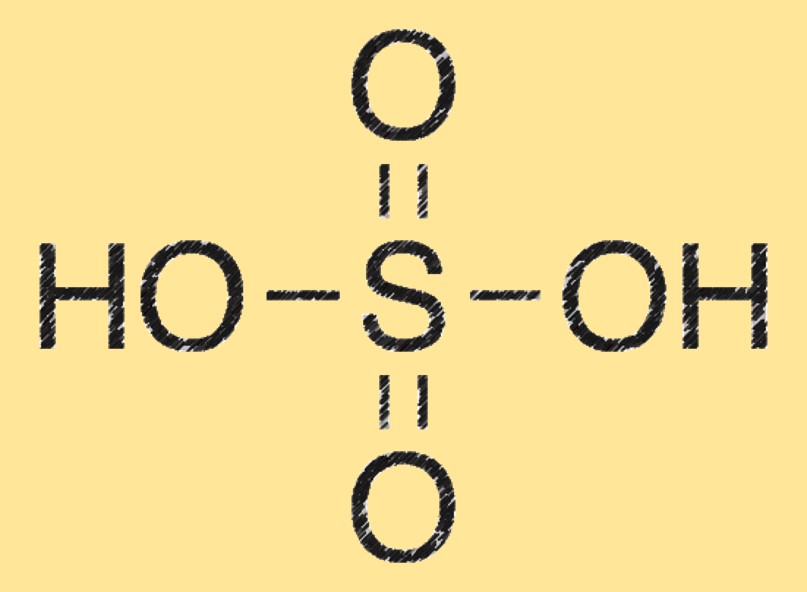
硫酸の分子量は 98.08 g/mol です。化学式 (H2SO4) に各元素の原子量を加算することで計算されます。
硫酸の構造
硫酸分子は、4 つの酸素 (O) 原子にも結合した硫黄 (S) 原子に結合した 2 つの水素 (H) 原子から構成されます。これは四面体の分子構造を持ち、強力な脱水剤です。
| 外観 | 無色透明の油状液体 |
| 比重 | 1.84 (水 = 1) |
| 色 | 無色 |
| 匂い | 刺激的で硫黄臭 |
| モル質量 | 98.079 g/モル |
| 密度 | 1,835g/mL |
| 融合点 | 10.5℃ |
| 沸点 | 337℃ |
| フラッシュドット | 140°F (60°C) |
| 水への溶解度 | 完全に混和可能 |
| 溶解性 | 水やアルコールに溶ける |
| 蒸気圧 | 40mmHg(20℃) |
| 蒸気密度 | 2.5 (空気 = 1) |
| pKa | -3 |
| pH | 1未満(強酸性) |
硫酸の安全性と危険性
硫酸は腐食性が高く危険な物質です。皮膚や目に接触すると重度の火傷や失明を引き起こす可能性があります。その蒸気を吸入すると、呼吸器系を刺激し、咳、喘鳴、息切れを引き起こすことがあります。可燃性で反応性があるため、換気の良い場所で手袋や保護眼鏡などの保護具を使用して慎重に取り扱う必要があります。表面を傷つけたり、人に危害を及ぼす可能性を避けるために、こぼれたものはすぐに拭き取ってください。安全に取り扱うためには、適切な保管とラベルの貼付が必要です。
| ハザードシンボル | 腐食性、刺激性、有害性 |
| セキュリティの説明 | 熱/火花/裸火/高温の表面から遠ざけてください。禁煙。換気の良い場所に保管してください。容器をしっかり閉めて保管してください。保護手袋/保護服/保護眼鏡/保護面を着用してください。 |
| 国連識別番号 | UN1830 |
| HSコード | 2815.11.00 |
| 危険等級 | 8 |
| 梱包グループ | Ⅱ |
| 毒性 | 経口: LD50 = 1.2 g/kg (ラット) |
硫酸の合成方法
H2SO4 は、コンタクトプロセスやマスターチャンバープロセスなど、いくつかの方法で合成できます。
接触プロセスは、硫酸の工業的生産に最も広く使用されている方法であり、二酸化硫黄を三酸化硫黄に酸化し、次に三酸化硫黄と水とを反応させて H2SO4 を生成します。
一方、リードチャンバープロセスでは、触媒(通常は二酸化鉛)の存在下で二酸化硫黄を二酸化窒素で酸化し、得られた三酸化硫黄を水と反応させます。どちらの方法でも、異なるレベルの純度および濃度の H2SO4 が生成され、必要に応じてさらに精製および濃縮できます。
硫酸の用途
H2SO4 は多用途の化学物質であり、さまざまな産業で広く使用されています。人々は肥料、洗剤、染料、顔料の製造に硫酸をよく使用します。また、石油製品の精製、鉱物や鉱石の加工、硝酸や硫酸塩などの化学薬品の製造にも役割を果たします。研究室では H2SO4 を試薬として使用し、化学反応の触媒として機能します。鉛蓄電池は電解液として硫酸を使用しており、鉄鋼メーカーはめっきや塗装の前に錆やスケールを除去するための酸洗に硫酸を使用しています。
全体として、H2SO4 は多くの工業プロセスで重要な役割を果たしており、世界で最も重要な化学物質の 1 つとなっています。
質問:
硫酸は強酸ですか?
はい、H2SO4 は強酸です。強酸とは、水中で完全に解離して水素イオン (H+) を生成する酸のことで、すべての水素イオンが溶液に与えられることを意味します。硫酸は最も強い酸の 1 つと考えられており、酸性度が高いため、非常に反応性が高く、腐食性が高くなります。人や環境への危害を避けるためには、硫酸の適切な取り扱いと保管が不可欠です。
硫酸は何に使われますか?
硫酸はさまざまな産業や用途で広く使用されています。 H2SO4 の最も一般的な用途には次のようなものがあります。
- 肥料の製造: 硫酸は、多くの肥料の重要な成分であるリン酸の製造に使用されます。
- 石油精製: 硫酸は、精製プロセス中に原油から硫黄化合物などの不純物を除去するために使用されます。
- 金属加工: 硫酸は、金属鉱石の精製だけでなく、鉄や鋼から錆やスケールを除去するために金属加工に使用されます。
- 製造: 硫酸は、洗剤、染料、顔料、その他の化学薬品を含むさまざまな製品の製造に使用されます。
- 自動車用バッテリー: 硫酸は、自動車やその他の乗り物で一般的に使用される鉛酸バッテリーの電解質として使用されます。
- 実験用試薬: 硫酸は、反応性が高く、多くの物質を溶解する能力があるため、実験用試薬として一般的に使用されます。
硫酸とはどんな酸ですか?
H2SO4 は強力な無機酸です。二プロトン酸として分類される H2SO4 は、溶液に 2 つの水素イオン (H+) を与え、強力な鉱酸になります。 H2SO4 は反応性が高く腐食性が高いため、人や環境への害を避けるために取り扱いや保管する際には注意が必要です。産業界は、肥料、洗剤、染料、顔料、その他の化学薬品の製造、石油製品の精製、金属鉱石の加工などのプロセスで硫酸を広く使用しています。
硫酸の式は何ですか?
硫酸の化学式は H2SO4 です。
ビトリオール油とは何ですか?
ビトリオール油は、強力で腐食性の高い化学物質である硫酸の別名です。これは、肥料、洗剤、染料の製造だけでなく、石油精製や他の化学物質の加工にもよく使用されます。
