硫酸カリウム (K2SO4) は、カリウム、硫黄、酸素を含む化合物です。植物に必須の栄養素を提供し、土壌の品質を改善するための肥料として一般的に使用されます。
| IUPAC名 | 硫酸カリウム |
| 分子式 | K2SO4 |
| CAS番号 | 7778-80-5 |
| 同義語 | 硫酸、二カリウム塩;硫酸二カリウム;アルカナイト。硫酸、カリウム塩 (1:2);硫酸カリウム;サル・ポリクレスタム。難解な重複 |
| インチチ | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
硫酸カリウムの性質
硫酸カリウムの配合
硫酸カリウムの化学式はK2SO4です。これは、各硫酸カリウム分子には 2 つのカリウム原子、1 つの硫黄原子、および 4 つの酸素原子が含まれていることを意味します。硫酸カリウムの式は、化合物に関係する反応の化学量論を決定したり、特定の用途に必要な硫酸カリウムの量を計算したりするのに役立ちます。
硫酸カリウムのモル質量
K2SO4 のモル質量は約 174,259 g/mol です。この値は、化合物内の各元素の原子量 (カリウム原子 2 個、硫黄原子 1 個、酸素原子 4 個) を加算することによって計算されます。モル質量は、肥料生産や実験室実験などの特定の用途に必要な K2SO4 の量を決定するのに有用な値です。
硫酸カリウムの沸点
K2SO4 の沸点は約 1,690 °C (3,074 °F) です。これは、化合物が液体から気体に変化する温度です。 K2SO4 は沸点が高いため、肥料や工業用化学薬品の製造など、高温安定性が必要な用途に役立ちます。
硫酸カリウムの融点
K2SO4 の融点は約 1.069 °C (1.956 °F) です。これは、固体化合物が液体状態に変化する温度です。 K2SO4 は融点が比較的高いため、ガラス、セラミック、肥料の製造などの高温用途に役立ちます。
硫酸カリウムの密度 g/mL
K2SO4 の密度は室温で約 2.66 g/mL です。これは、1 ミリリットルの K2SO4 の重さが 2.66 グラムであることを意味します。 K2SO4 の密度は温度と圧力に依存し、特定の用途に必要な化合物の質量または体積を計算するために使用できます。
硫酸カリウムの分子量
K2SO4 の分子量は 174,259 g/mol です。この値は、化合物内のすべての元素の原子量を加算することによって計算されます。分子量は、肥料や工業用化学薬品など、特定の用途に必要な K2SO4 の量を計算するのに役立ちます。
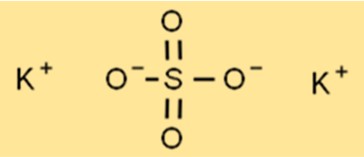
硫酸カリウムの構造
K2SO4 の構造は結晶格子構造であり、各カリウム イオンが 6 つの八面体状の酸素イオンに囲まれています。硫黄原子は格子の中心に位置し、各硫黄原子は四面体状の 4 つの酸素イオンに囲まれています。この格子構造により、K2SO4 に高い融点や沸点などの特徴的な特性が与えられます。
| 外観 | 白色の結晶固体 |
| 比重 | 20℃で2.66 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 174,259 g/モル |
| 密度 | 2.66 g/cm3 (20°C) |
| 融合点 | 1069°C (1956°F) |
| 沸点 | 1,690°C (3,074°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 111 g/L(20℃) |
| 溶解性 | 水に可溶、エタノールに不溶 |
| 蒸気圧 | 0.0mmHg(25℃) |
| 蒸気密度 | 適用できない |
| pKa | 1位:2.17; 2番目:午前7時20分。 3位:11.8 |
| pH | 5.5-8.5 (1%溶液) |
硫酸カリウムの安全性と危険性
K2SO4 は一般に、工業、農業、実験室での使用が安全であると考えられています。ただし、この化合物を大量に摂取または吸入すると、皮膚、目、呼吸器系に炎症や損傷を引き起こす可能性があります。さらに、K2SO4 は強酸などの特定の化学物質と反応して、危険な煙や火災を引き起こす可能性があります。 K2SO4 は、適切な保護具を使用し、安全上の指示に従って慎重に取り扱うことが重要です。 K2SO4 の保管は、不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | S24/25: 皮膚や目との接触を避けてください。 |
| 国連識別番号 | 国連 6066 |
| HSコード | 3104.30.00 |
| 危険等級 | 輸送には危険ではない |
| 梱包グループ | 適用できない |
| 毒性 | 低毒性 |
硫酸カリウムの合成法
K2SO4 を合成するにはいくつかの方法が存在します。
一般的な方法には、塩化カリウムと硫酸の反応が含まれます。この反応により、副生成物として K2SO4 と塩化水素が生成されます。
別の方法には、水酸化カリウムと硫酸の反応が含まれます。この反応では、副生成物として K2SO4 と水も生成されます。
K2SO4 は、K2SO4、硫酸マグネシウム、塩化ナトリウムを含む天然鉱物であるラングベイナイト鉱物からも得られます。通常、鉱山労働者は鉱物を抽出し、それを処理して不純物を除去し、K2SO4 を分離します。
K2SO4 を生成する別の方法には、炭酸カリウムと硫酸の反応が含まれます。この反応では、副生成物として K2SO4 と二酸化炭素が生成されます。
硫酸カリウムの用途
K2SO4 は、さまざまな業界で幅広い用途があります。 K2SO4 の最も一般的な用途のいくつかを以下に示します。
- 肥料:カリウム含有量が高いため、人気のある肥料です。果物、野菜、その他の作物の栽培に使用されます。
- ガラス産業: ガラス製造のフラックスとして使用されます。これによりガラスの融点が下がり、耐久性が向上します。
- 製薬産業: 下剤や電解質補充液など、さまざまな医薬品の成分として使用されます。
- 食品産業: 酸度を調整するための食品添加物として、また焼き菓子の脱離剤として使用されます。
- 産業用途: アルミニウム、炭酸カリウム、その他の化学物質の製造を含む、いくつかの産業用途で使用されます。
- 動物用飼料: 健康な成長と発育を促進するために、家畜や家禽の栄養補助食品として使用されます。
- 水処理:ボイラーなどのスケールや腐食を抑制する水処理に使用されます。
質問:
Q: 硫酸カリウムは溶けますか?
A: はい、K2SO4 は水に溶けます。室温での溶解度は約 111 g/L です。
Q: 臭化ストロンチウムと硫酸カリウムが反応すると、固体生成物は何になりますか?
A: 臭化ストロンチウムと K2SO4 が反応すると、不溶性の白色固体である硫酸ストロンチウム (SrSO4) が固体生成物として生成されます。
Q: 硝酸銀と硫酸カリウムの置換反応では他に何が生成されますか?
A: 硝酸銀とK2SO4の置換反応では、硫酸銀(Ag2SO4)や硝酸カリウム(KNO3)も生成されます。
Q: 硫酸カリウムは酸ですか、それとも塩基ですか?
A: K2SO4 は酸でも塩基でもなく、塩です。酸(硫酸)と塩基(水酸化カリウム)の中和反応により生成されます。
Q: k2so4 は水に溶けますか?
A: はい、K2SO4 は水に溶けます。非常に溶解性が高く、温度とともに溶解度が増加します。
Q: h2so4 が naoh と反応すると、どのような塩が生成されますか? k2so3 na2so4 na2so3 k2so4 A: H2SO4 が NaOH と反応すると、水と Na2SO4 (硫酸ナトリウム) の塩が生成されます。
Q: 15.0 g の k2so4 には何モルの k2so4 が含まれますか?
A: 15.0 g の K2SO4 中の K2SO4 のモル数を決定するには、指定された質量を K2SO4 のモル質量 (174.259 g/mol) で割る必要があります。したがって、15.0 g 中の K2SO4 のモル数は 0.086 モルです。
q:pb(no3)2(aq)とk2so4(aq)を混合したときに生じる沈殿の式は何になるでしょうか?
A: Pb(NO3)2 (水溶液) と K2SO4 (水溶液) を混合すると、不溶性の白色固体である PbSO4 (硫酸鉛) が沈殿として形成されます。この反応の平衡式は、Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3 です。
